Diflúor
El diflúor es una molécula diatómica inorgánica de fórmula F2 (el diflúor es una Sustancia simple de flúor).
| Diflúor | ||
|---|---|---|
| General | ||
| Fórmula estructural |
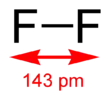 | |
| Fórmula molecular | ? | |
| Identificadores | ||
| Número CAS | 7782-41-4[1] | |
| ChEBI | 30236 | |
| ChemSpider | 22932 | |
| PubChem | 24524 | |
| UNII | 284SYP0193 | |
| Propiedades físicas | ||
| Masa molar | 37,996806 g/mol | |
Características
Es un gas de color amarillo, tóxico, oxidante, que reacciona con todos los elementos, incluyendo gases nobles, exceptuando helio, neón y argón. Este gas se ha encontrado de forma natural en la Antozonita en forma de inclusiones, este es generado por la ionización del fluoruro de calcio. Los únicos materiales que no ataca son el platino y teflón.
Aunque se presente como tratamiento médico, este compuesto puede causar la muerte pues resulta nocivo al inhalarse. Es muy irritante en contacto con la piel o los ojos y también es capaz de explotar al descomponerse. No tiene punto de autoignición debido a que no es inflamable.
Reacciona con agua formando ácido fluorhídrico y ácido hipofluoroso, y retornando en agua y flúor.
| Características físicas |
|---|
| Punto de fusión: -219,61 °C |
| Punto de ebullición: -188,13 °C |
| Fórmula molecular: F2 |
| Densidad: 1553 g/m³ |
| Peso molecular: 37,997 g/mol |
| Temperatura crítica: -129 °C |
| Presión crítica: 55 atm |
Historia
El diflúor fue sintetizado por Henri Moissan en 1886 en estado gaseoso, por la electrólisis la solución de ácido fluorhídrico y fluorhidrato de potasio.Aunque no fue el primero en saber de su existencia.[2][3]
Etimología
Proveniente del prefijo «di» («doble») y flúor.
Producción
El diflúor se puede sintetizar de la reacción de bifluoruro de potasio con sí mismo.
Geometría
El ángulo entre los átomos es de 180º y la distancia entre ellos es de 143 pm. El enlace entre estos dos átomos es covalente, debido a la similitud de su configuración electrónica.[5]
Usos
Se usa en la síntesis de difluoruro de oxígeno, trifluoruro de cloro, trifloruro de bromo, fluoruro de Níquel (II) y síntesis de difluoruro de dioxígeno:
(síntesis de difluoruro de oxígeno).[4]
(síntesis de difluoruro de dioxigeno)
(síntesis de trifluoruro de cloro)
(síntesis de trifluoruro de bromo)
(síntesis de fluoruro de Níquel)
- Se utiliza para el fresado químico en los semiconductores.
- A bajas temperatura se utiliza como compuesto criogénico
Véase también
Referencias
- Número CAS
- «Henri Moissan». EcuRed. Consultado el 9 de marzo de 2017.
- O'Leary, Donal (2000). «Fluorine». University College Cork (en inglés). Archivado desde el original el 6 de marzo de 2017.
- «F2 chemical reactions». Chemiday (en inglés). Consultado el 9 de marzo de 2017.
- Rody Abraham (13 de marzo de 2008). «Qué es el difluor y cuál es su fórmula?». Yahoo! respuestas.
Bibliografía
- Lide, David R. (2008). CRC handbook of chemistry and physics (en inglés) (89.ª edición). CRC Press. pp. 10-205. ISBN 9781420066791.
- OIT; OMS (2001). «Flúor». Fichas Internacionales de Seguridad Química.
- Parlamento Europeo; Consejo de la Unión Europea (31 de diciembre de 2008). «Reglamento (CE) nº 1272/2008 del Parlamento Europeo y del Consejo, de 16 de diciembre de 2008, sobre clasificación, etiquetado y envasado de sustancias y mezclas, y por el que se modifican y derogan las Directivas 67/548/CEE y 1999/45/CE y se modifica el Reglamento (CE) nº 1907/2006». Diario Oficial de la Unión Europea. p. 362. «009-001-00-0 Fluorine ».
- Perry, R. H.; Green, D. W.; Maloney, J. O. (1997). Perry's chemical engineers' handbook (en inglés) (7.ª edición). McGraw-Hill. ISBN 0-07-049841-5.
- Tipler, Paul A. (1999). Physics for scientists and engineers (en inglés) 1 (4.ª edición). W H Freeman & Co. ISBN 1-57259-491-8.
Enlaces externos
- «Diflúor» en Science Amusante (en francés)
- Sanderson, Katharine (11 de julio de 2012). «Stinky rocks hide Earth’s only haven for natural fluorine». Nature (en inglés).
- «Properties of Various Gases». Flexware (en inglés). Archivado desde el original el 19 de mayo de 2012.
- «Compuestos inorgánicos» en EcuRed