Ecuación de Fenske
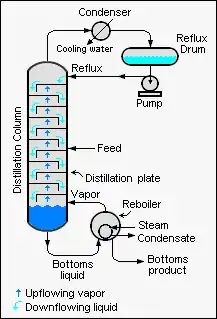
La ecuación de Fenske en la destilación fraccionada continua es una ecuación utilizada para calcular el número mínimo de platos teóricos requeridos para la separación de una corriente de alimentación binaria mediante una columna de fraccionamiento que se opera a reflujo total (es decir, lo que significa que no hay destilado del producto de cabeza). siendo retirado de la columna).
| Destilación | |
|---|---|
 | |
| Ramas | |
| Ley de Raoult / Ley de Dalton / Reflujo / Ecuación de Fenske / Método de McCabe-Thiele / Plato teórico / Presión parcial / Equilibrio vapor-líquido | |
| Procesos industriales | |
| |
| Métodos de laboratorio | |
| Técnicas | |
La ecuación fue derivada en 1932 por Merrell Fenske,[1] un profesor que se desempeñó como jefe del departamento de ingeniería química en la Universidad Estatal de Pensilvania desde 1959 hasta 1969.[2]
Cuando se diseñan torres de destilación industriales continuas a gran escala, es muy útil calcular primero el número mínimo de placas teóricas requeridas para obtener la composición del producto deseado.
Versiones comunes de la ecuación de Fenske
Esta es una de las muchas versiones diferentes pero equivalentes de la ecuación de Fenske, válida solo para mezclas binarias:[3][4][5][6][7]
| Símbolo | Nombre |
|---|---|
| Número mínimo de placas teóricas requeridas al reflujo total (de las cuales el recalentador es uno) | |
| Fracción molar de componente más volátil en el destilado de cabeza | |
| Fracción molar de componente más volátil en los fondos | |
| Volatilidad relativa promedio del componente más volátil al componente menos volátil |
Para una mezcla de múltiples componentes se mantiene la siguiente fórmula. Para facilitar la expresión, los componentes más volátiles y los menos volátiles se conocen comúnmente como la light key (LK) y la heavy key (HK), respectivamente. Usando esa terminología, la ecuación anterior se puede expresar como:[4]
o también:
Si la volatilidad relativa de la tecla ligera a la tecla pesada es constante desde la parte superior de la columna hasta la parte inferior de la columna, entonces es simple . Si la volatilidad relativa no es constante de arriba abajo de la columna, se puede usar la siguiente aproximación:[3]
| Símbolo | Nombre |
|---|---|
| Volatilidad relativa promedio del componente más volátil al componente menos volátil | |
| Volatilidad relativa de clave ligera a clave pesada en la parte superior (top) de la columna | |
| Volatilidad relativa de clave ligera a clave pesada en la parte inferior (bottom) de la columna |
Las formas anteriores de la ecuación de Fenske pueden modificarse para su uso en la destilación de reflujo total de alimentaciones de múltiples componentes.[6] También es útil para resolver problemas de extracción líquido-líquido, ya que un sistema de extracción también puede representarse como una serie de etapas de equilibrio y la solubilidad relativa puede sustituirse por una volatilidad relativa.
Otra forma de la ecuación de Fenske
Una derivación de otra forma de la ecuación de Fenske para su uso en cromatografía de gases está disponible en el sitio web de la Academia Naval de los Estados Unidos. Usando la ley de Raoult y la Ley de Dalton para una serie de ciclos de condensación y evaporación (es decir, etapas de equilibrio), se obtiene la siguiente forma de la ecuación de Fenske:
| Símbolo | Nombre |
|---|---|
| Número de etapas de equilibrio | |
| Fracción molar del componente n en la fase de vapor | |
| Fracción molar del componente n en la fase líquida | |
| Presión de vapor del componente puro n |
Véase también
Referencias
- MR Fenske (1932). Ind.Eng. Chem. , Vol. 24 : 482.
- Capítulo 4 Archivado el 31 de mayo de 2014 en Wayback Machine. , (Del sitio web de Cal Poly Pomona en California. Notas de la clase del profesor Thuan Ke Nguyen para el curso titulado CHE313, Transferencia masiva . Consulte la página 4-42.)
- David S.J. Jones and Peter P. Pujado (Editors) (2006). Handbook of Petroleum Processing (1st edición). Springer. ISBN 1-4020-2819-9.
- Henry Kister (1992). Distillation Design (1st edición). McGraw-Hill. ISBN 0-07-034909-6.
- A. Kayode Coker (2010). Ludwig's Applied Process Design for Chemical and Petrochemical Plants, Volume 2 (4th edición). Gulf Professional Publishers. ISBN 978-0-7506-8366-1.
- Binay K. Dutta (2007). Principles of Mass Transfer and Separation Processes. Prentice Hall of India. ISBN 978-81-203-2990-4.
Enlaces externos
- Lecture Notes Archivado el 2 de mayo de 2012 en Wayback Machine. (R.M. Price, Christian Brothers University, Tennessee)
- Studies in Chemical Process Design and Synthesis Archivado el 11 de abril de 2020 en Wayback Machine., Y. A. Liu, T.E. Quantrille, and S. Chengt, Ind. Eng. Chem. Res., Volume 29, 1990
- Multi-component Distillation (enlace roto disponible en Internet Archive; véase el historial, la primera versión y la última). (M.B. Jennings, San Jose State University)