Enlace de halógeno
El enlace de halógeno o puente de halógeno es una interacción entre un átomo de halógeno que posee un enlace covalente y un átomo electronegativo (base de lewis). Se produce por la anisotropía en la distribución de la densidad de carga sobre el halógeno que da como resultado una región positiva (agujero σ) sobre el eje del enlace halógeno-sustituyente.[1] Ocurre cuando existe evidencia de una interacción atractiva neta entre una región electrofílica asociada con un átomo de halógeno en una entidad molecular y una región nucleofílica de otra molécula o de la misma.[2] Es homólogo a los puentes de hidrógeno.
Características del Enlace
Comparación entre el puente de hidrógeno y el puente de halógeno.
- Puente de Hidrógeno
- Puente de Halógeno
En ambos casos, la entidad A (aceptor de puente de hidrógeno/halógeno) es el átomo, molécula o grupo que dona electrones a la especie deficiente de densidad electrónica H-D o X-D (donador de puente de hidrógeno/halógeno) y H o X es el átomo de hidrógeno o halógeno involucrado en la interacción. Nótese que el donador de puente de halógeno acepta electrones mientras que el aceptor de puente de halógeno dona electrones.
Una relación paralela puede ser fácilmente dibujada entre el puente de halógeno y el de hidrógeno. En ambos tipos de puente, existe una relación donador de electrones-aceptor de electrones. La diferencia entre ambas interacciones es qué especies pueden actuar como aceptores y donadores. En el puente de hidrógeno, un átomo de hidrógeno actúa como el aceptor de electrones y forma una interacción no covalente al aceptar densidad electrónica de un sitio rico en electrones. En el puente de halógeno, un átomo de halógeno es el aceptor de electrones. De manera simultánea, el enlace covalente normal entre el hidrógeno o el halógeno y el grupo que los sostiene se debilita, por lo que la densidad electrónica en el hidrógeno o el halógeno disminuye. La transferencia de densidades electrónicas da como resultado una penetración de los volúmenes de Van de Waals[3]
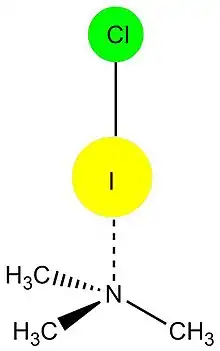
Los halógenos que participan en el enlace de halógeno son: yodo, bromo, cloro y a veces flúor. Los cuatro halógenos son capaces de actuar como donadores de puente de halógeno y siguen la tendencia:
Siendo el yodo el que usualmente forma las interacciones más fuertes.[4]
Los dihalógenos (I2, Br2, etc.) tienden a formar enlaces de halógeno fuertes. La fuerza y efectividad del puente en compuestos de cloro y flúor depende de la naturaleza del donador. Si el halógeno está unido a un sustituyente electronegativo (que atrae densidad electrónica), es más probable que forme enlaces de halógeno más fuertes.[5]
Por ejemplo, los yodo-perfluoroalcanos son compuestos diseñados para la ingeniería de cristales que poseen enlaces de halógeno. Además, esta es la razón por la que F2 actúa como un fuerte donador de puente pero los fluorocarbonos son donadores débiles, es decir, el grupo alquilo conectado al flúor no es electronegativo, por lo que los puentes son poco efectivos. Sumado a esto, la base de Lewis (aceptor de puente) tiende a ser electronegativa también, por lo que los aniones son mejores aceptores de puente que las moléculas neutras.
Los enlaces de halógeno son interacciones fuertes, específicas y direccionales, lo que da origen a estructuras bien definidas. La fuerza de los enlaces varía entre 5 y 180 kJ/mol. Es comparable con los enlaces de halógeno, que son ligeramente más débiles. Los enlaces de halógeno tienden a formarse en ángulos de 180°, como lo señaló Odd Hassel en sus estudios con bromo y 1,4-dioxano en 1954. Otro factor que contribuye a la fuerza del enlace de halógeno proviene de la distancia entre el halógeno y el aceptor. La naturaleza atractiva de los puentes de halógeno da como resultado que la distancia entre donador y aceptor sea más corta que la suma de los radios de Van der Waals. La interacción se vuelve más fuerte conforme la distancia halógeno-receptor disminuye.
Historia
En 1814, Jean Jacques Colin describió la formación de un líquido con brillo metálico cuando mezclaba amoniaco gaseoso seco con yodo. La composición precisa del complejo I2...NH3fue establecida hasta 50 años después por Frederick Guthrie.[6] En su experimento, colocó I2 en amoniaco líquido. La naturaleza de la interacción molecular fue entendida otros cincuenta años después a través de los descubrimientos de Robert Mulliken sobre las interacciones de transferencia de carga y su detallada descripción por Odd Hassel.
En 1950, Robert Mulliken desarrolló una teoría detallada acerca de los complejos donador-aceptor de electrones, clasificándolos como exteriores o interiores.[7][8][9] Los complejos exteriores son aquellos en las que las interacciones intermoleculares entre donador y aceptor de electrones son débiles y tienen poca transferencia de carga. Los complejos interiores tienen una redistribución de carga importante. La teoría de Mulliken ha sido usada para describir los mecanismos por los que la formación de los puentes de halógeno ocurren.
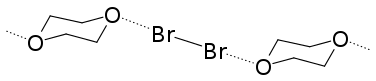
Al mismo tiempo que Mulliken desarrolló su teoría, estudios de cristalografía realizados por Hassel comenzaron a publicarse y se convirtieron rápidamente en un parteaguas en la comprensión de la formación de los puentes de hidrógeno y sus características.
El primer estudio de cristalografía de rayos X de Hassel salió a la luz en 1954. En su experimento, su equipo fue capaz de determinar la estructura del bromuro de 1,4-dioxanato utilizando difracción de rayos X.[10] El experimentó reveló que una interacción intermolecular estaba presente entre los átomos de oxígeno del dioxano y los átomos de bromo. La distancia O-Br medida en el cristal fue de 2.71 Å, lo que indicaba una interacción fuerte entre ambos átomos. Además, la distancia es menor que la suma de los radios de Van der Waals del oxígeno y del bromo (3.35 Å). El ángulo entre los enlaces O-Br y Br-Br fue de alrededor de 180°. Esta fue la primera evidencia de las características comunes de los puentes de halógeno y llevaron a Hassel a concluir que los átomos de halógeno están unidos directamente con un donador de pares electrónicos con una dirección de enlace que coincide con los ejes de los orbitales que ocupan los electrones libres en la molécula donadora.[11]
En 1969, Hassel fue galardonado con el premio Nobel de Química por el descubrimiento de que los halógenos pueden actuar como electrófilos aceptores de electrones y que en presencia de donadores de electrones, se ensamblan en complejos de transferencia de carga con una estructura cristalina altamente direccional.[12] Una revisión acerca de los donadores y aceptores electrónicos fue brindada por Henry Bent en 1968.[13] El uso del término Halogen Bond (enlace de halógeno) no fue implementado hasta 1978 por J.M. Dumas y su equipo quienes investigaron complejos de CCl4, CBr4, SiCl4 y SiBr4 con THF, tetrahidropirano, piridina, anisol y di-n-butil éter en disolventes orgánicos.[14]
Sin embargo, no fue hasta mediados de la década de 1990 que la naturaleza y aplicaciones del enlace de halógeno se comenzaron a estudiar ampliamente. Legon y colaboradores realizaron un trabajo extensivo y sistemático alrededor de una variedad de aductos de enlaces de halógeno en fase gas mediante espectroscopía de microondas que atrajo la atención a las similitudes entre los puentes de hidrógeno y los puentes de halógeno.[15] Cálculos computacionales realizados por Politzer y Murray fueron de particular importancia pues revelaron que la alta direccionalidad del enlace de halógeno es resultado de una distribución anisotrópica de la densidad electrónica alrededor del núcleo del halógeno[16] y sentaron la definición del "agujero σ".[17]
Actualmente, los puentes de halógeno están siendo usados para una variedad de aplicación que incluyen la ingeniería de cristales, química supramolecular, ciencias de polímeros, cristales líquidos, materiales conductores y química medicinal.[18][19]
Aplicaciones
Ingeniería de cristales
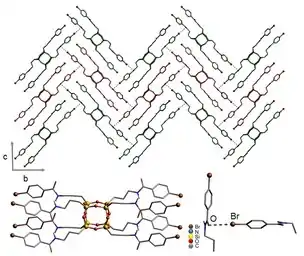
La ingeniería de cristales es un área de investigación en crecimiento que conecta la química del estado sólido con la química supramolecular.[21] Este campo es multidisciplinario y combina disciplinas tradicionales como la cristalografía, la química orgánica y la química inorgánica. En 1971, G. Schmidt estableció las bases del campo con una publicación acerca de la fotodimerización en estado sólido.[22] La definición más reciente identifica la ingeniería de cristales como el uso de interacciones intermoleculares para la cristalización y el desarrollo de nuevas sustancias con diferentes propiedades fisicoquímicas. Previo al descubrimiento del enlace de halógeno, la ingeniería de cristales involucraba el uso de puentes de hidrógeno, química de coordinación e interacciones inter-iónicas para el desarrollo de líquidos cristalinos y sólidos cristalinos. El puente de halógeno es utilizado para la organización de sales de radicales catiónicos, fabricación de conductores moleculares y la creación de cristales líquidos. Desde el descubrimiento del puente de halógeno, nuevas entidades moleculares han sido sintetizadas.[23] Debido a la naturaleza química inusual de enlace de halógeno, se ha utilizado como herramienta adicional en el desarrollo de la ingeniería de cristales.[24]
El primer uso reportado del enlace de halógeno en la formación de cristales líquidos fue por H.L. Nguyen[25] quien, en un esfuerzo para sintetizar cristales líquidos, utilizó alcoxistilbazoles y pentafluoroyodobenceno. Estudios previos habían demostrado la utilidad el pentafluoroyodobenceno para la formación de estructuras sólidas.[2] Algunos alcoxistilbazoles han sido usados para óptica no lineal y metalomesogenos.[26]
Enlaces externos
Referencias
- Saavedra Rivas, Leslie (2013). Entendiendo los puentes de halógeno desde un punto de vista teórico. Consultado el 8 de mayo de 2020.
- Desiraju, Gautam R.; Ho, P. Shing; Kloo, Lars; Legon, Anthony C.; Marquardt, Roberto; Metrangolo, Pierangelo; Politzer, Peter; Resnati, Giuseppe et al. (10 de julio de 2013). «Definition of the halogen bond (IUPAC Recommendations 2013)». Pure and Applied Chemistry (en inglés) 85 (8): 1711-1713. ISSN 0033-4545. doi:10.1351/PAC-REC-12-05-10. Consultado el 8 de mayo de 2020.
- Metrangolo, Pierangelo; Resnati, Giuseppe (18 de junio de 2001). «Halogen Bonding: A Paradigm in Supramolecular Chemistry». Chemistry – A European Journal 7 (12): 2511-2519. ISSN 0947-6539. doi:10.1002/1521-3765(20010618)7:123.0.CO;2-T. Consultado el 8 de mayo de 2020.
- Politzer, Peter; Lane, Pat; Concha, Monica C.; Ma, Yuguang; Murray, Jane S. (1 de febrero de 2007). «An overview of halogen bonding». Journal of Molecular Modeling (en inglés) 13 (2): 305-311. ISSN 0948-5023. doi:10.1007/s00894-006-0154-7. Consultado el 8 de mayo de 2020.
- Metrangolo, Pierangelo; Neukirch, Hannes; Pilati, Tullio; Resnati, Giuseppe (1 de mayo de 2005). «Halogen Bonding Based Recognition Processes: A World Parallel to Hydrogen Bonding». Accounts of Chemical Research 38 (5): 386-395. ISSN 0001-4842. doi:10.1021/ar0400995. Consultado el 8 de mayo de 2020.
- Guthrie, Frederick (1 de enero de 1863). «XXVIII.—On the iodide of iodammonium». Journal of the Chemical Society (en inglés) 16 (0): 239-244. ISSN 0368-1769. doi:10.1039/JS8631600239. Consultado el 9 de mayo de 2020.
- Mulliken, Robert S. (1 de enero de 1950). «Structures of Complexes Formed by Halogen Molecules with Aromatic and with Oxygenated Solvents1». Journal of the American Chemical Society 72 (1): 600-608. ISSN 0002-7863. doi:10.1021/ja01157a151. Consultado el 9 de mayo de 2020.
- Mulliken, Robert S. (1 de febrero de 1952). «Molecular Compounds and their Spectra. II». Journal of the American Chemical Society 74 (3): 811-824. ISSN 0002-7863. doi:10.1021/ja01123a067. Consultado el 9 de mayo de 2020.
- Mulliken, Robert S. (1 de julio de 1952). «Molecular Compounds and their Spectra. III. The Interaction of Electron Donors and Acceptors». The Journal of Physical Chemistry 56 (7): 801-822. ISSN 0022-3654. doi:10.1021/j150499a001. Consultado el 9 de mayo de 2020.
- Hassel, O.; Hvoslef, J.; Vihovde, E. Hadler; Sörensen, Nils Andreas (1954). «The Structure of Bromine 1,4-Dioxanate.». Acta Chemica Scandinavica (en inglés) 8: 873-873. ISSN 0904-213X. doi:10.3891/acta.chem.scand.08-0873. Consultado el 9 de mayo de 2020.
- Hassel, Odd (30 de octubre de 1970). «Structural Aspects of Interatomic Charge-Transfer Bonding». Science (en inglés) 170 (3957): 497-502. ISSN 0036-8075. PMID 17799698. doi:10.1126/science.170.3957.497. Consultado el 9 de mayo de 2020.
- «The Nobel Prize in Chemistry 1969». NobelPrize.org (en inglés estadounidense). Consultado el 9 de mayo de 2020.
- Bent, Henry A. (26 de agosto de 1968). «Structural chemistry of donor-acceptor interactions». Chemical Reviews 68 (5): 587-648. ISSN 0009-2665. doi:10.1021/cr60255a003. Consultado el 9 de mayo de 2020.
- DUMAS, JM; JM, DUMAS; H, PEURICHARD; M, GOMEL (1978). «CX4... BASE INTERACTION AS MODELS OF WEAK CHARGE-TRANSFER INTERACTIONS: COMPARISON WITH STRONG CHARGE-TRANSFER AND HYDROGEN-BOND INTERACTIONS.». CX4... BASE INTERACTION AS MODELS OF WEAK CHARGE-TRANSFER INTERACTIONS: COMPARISON WITH STRONG CHARGE-TRANSFER AND HYDROGEN-BOND INTERACTIONS. Consultado el 9 de mayo de 2020.
- Legon, Anthony C. (1999). «Prereactive Complexes of Dihalogens XY with Lewis Bases B in the Gas Phase: A Systematic Case for the Halogen Analogue B⋅⋅⋅XY of the Hydrogen Bond B⋅⋅⋅HX». Angewandte Chemie International Edition (en inglés) 38 (18): 2686-2714. ISSN 1521-3773. doi:10.1002/(SICI)1521-3773(19990917)38:183.0.CO;2-6. Consultado el 9 de mayo de 2020.
- Politzer, Peter; Murray, Jane S.; Clark, Timothy (6 de julio de 2010). «Halogen bonding: an electrostatically-driven highly directional noncovalent interaction». Physical Chemistry Chemical Physics (en inglés) 12 (28): 7748-7757. ISSN 1463-9084. doi:10.1039/C004189K. Consultado el 9 de mayo de 2020.
- Clark, Timothy; Hennemann, Matthias; Murray, Jane S.; Politzer, Peter (1 de febrero de 2007). «Halogen bonding: the σ-hole». Journal of Molecular Modeling (en inglés) 13 (2): 291-296. ISSN 0948-5023. doi:10.1007/s00894-006-0130-2. Consultado el 9 de mayo de 2020.
- Gilday, Lydia C.; Robinson, Sean W.; Barendt, Timothy A.; Langton, Matthew J.; Mullaney, Benjamin R.; Beer, Paul D. (12 de agosto de 2015). «Halogen Bonding in Supramolecular Chemistry». Chemical Reviews 115 (15): 7118-7195. ISSN 0009-2665. doi:10.1021/cr500674c. Consultado el 9 de mayo de 2020.
- Cavallo, G., Metrangolo, P., Milani, R., Pilati, T., Priimagi, A., Resnati, G. and Terraneo, G., 2016. The Halogen Bond. Chemical Reviews, 116(4), pp.2478-2601.https://doi.org/10.1021%2Facs.chemrev.5b00484
- Janeta, Mateusz; Szafert, Sławomir (1 de octubre de 2017). «Synthesis, characterization and thermal properties of T8 type amido-POSS with p-halophenyl end-group». Journal of Organometallic Chemistry. Organometallic Chemistry: from Stereochemistry to Catalysis to Nanochemistry honoring Professor John Gladysz's 65 birthday (en inglés) 847: 173-183. ISSN 0022-328X. doi:10.1016/j.jorganchem.2017.05.044. Consultado el 10 de mayo de 2020.
- Braga, Dario; Desiraju, Gautam R.; Miller, Joel S.; Orpen, A. Guy; Price, Sarah (Sally) L. (4 de septiembre de 2002). «Innovation in crystal engineering». CrystEngComm (en inglés) 4 (83): 500-509. ISSN 1466-8033. doi:10.1039/B207466B. Consultado el 10 de mayo de 2020.
- Schmidt, G. M. J. (1 de enero de 1971). «Photodimerization in the solid state». Pure and Applied Chemistry (en inglés) 27 (4): 647-678. ISSN 0033-4545. doi:10.1351/pac197127040647. Consultado el 10 de mayo de 2020.
- Metrangolo, Pierangelo; Resnati, Giuseppe; Pilati, Tullio; Liantonio, Rosalba; Meyer, Franck (2007). «Engineering functional materials by halogen bonding». Journal of Polymer Science Part A: Polymer Chemistry (en inglés) 45 (1): 1-15. ISSN 1099-0518. doi:10.1002/pola.21725. Consultado el 10 de mayo de 2020.
- Metrangolo, Pierangelo; Pilati, Tullio; Terraneo, Giancarlo; Biella, Serena; Resnati, Giuseppe (1 de julio de 2009). «Anion coordination and anion-templated assembly under halogen bonding control». CrystEngComm (en inglés) 11 (7): 1187-1196. ISSN 1466-8033. doi:10.1039/B821300C. Consultado el 10 de mayo de 2020.
- Nguyen, H. Loc; Horton, Peter N.; Hursthouse, Michael B.; Legon, Anthony C.; Bruce, Duncan W. (1 de enero de 2004). «Halogen Bonding: A New Interaction for Liquid Crystal Formation». Journal of the American Chemical Society 126 (1): 16-17. ISSN 0002-7863. doi:10.1021/ja036994l. Consultado el 10 de mayo de 2020.
- Bruce, Duncan W. (1 de enero de 2001). Advances in Inorganic Chemistry (en inglés) 52. Academic Press. pp. 151-204. doi:10.1016/s0898-8838(05)52003-8. Consultado el 10 de mayo de 2020.