Epigenética conductual
La epigenética conductual es el campo de estudio que examina el papel de la epigenética en la conformación del comportamiento animal (incluyendo el humano). Es una ciencia experimental que trata de explicar cómo nutre la naturaleza, donde por naturaleza se refiere a la herencia biológica y nutrir se refiere a prácticamente todo lo que ocurre durante la vida (por ejemplo, la experiencia social, la dieta y la nutrición, Y la exposición a las toxinas). La epigenética conductual intenta proporcionar un marco para entender cómo la expresión de los genes está influenciada por las experiencias y el ambiente para producir diferencias individuales en la conducta, la cognición, la personalidad, y la salud mental.
La regulación genética epigenética implica cambios distintos de la secuencia del ADN e incluye cambios en las histonas (proteínas alrededor de las cuales se envuelve el ADN) y la metilación del ADN. Estos cambios epigenéticos pueden influir en el crecimiento de las neuronas en el cerebro en desarrollo, así como modificar la actividad de las neuronas en el cerebro del adulto. Juntos, estos cambios epigenéticos en la estructura y función de las neuronas pueden tener una marcada influencia en el comportamiento de un organismo.
Antecedentes
En biología, y específicamente en genética, la epigenética es el estudio de cambios heredables en la actividad génica que no son causados por cambios en la secuencia de ADN; El término también se puede utilizar para describir el estudio de las alteraciones estables a largo plazo en el potencial transcripcional de una célula que no son necesariamente hereditarias.
Ejemplos de mecanismos que producen tales cambios son la metilación del ADN y la modificación de las histonas, cada una de las cuales altera la forma en que se expresan los genes sin alterar la secuencia de ADN subyacente. La expresión génica puede controlarse mediante la acción de proteínas represoras que se unen a las regiones del silenciador del ADN.
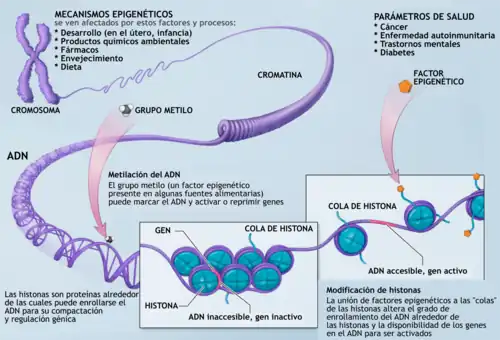
La epigenética tiene una fuerte influencia en el desarrollo de un organismo y puede alterar la expresión de rasgos individuales. Los cambios epigenéticos ocurren no solo en el feto en desarrollo, sino también en los individuos durante toda la vida humana. Debido a que algunas modificaciones epigenéticas pueden pasar de una generación a la siguiente, las generaciones posteriores pueden verse afectadas por los cambios epigenéticos que tuvieron lugar en los padres.
Descubrimiento
El primer ejemplo documentado de epigenética que afecta el comportamiento fue proporcionado por Michael Meaney y Moshe Szyf. Mientras trabajaban en la Universidad McGill en Montreal en 2004, descubrieron que el tipo y la cantidad de nutrir una rata madre proporciona en las primeras semanas de la infancia de la rata determina cómo responde a la rata más tarde en la vida . Esta sensibilidad al estrés se asoció a una regulación negativa en la expresión del receptor glucocorticoide en el cerebro. A su vez, esta baja regulación se encontró que es una consecuencia de la extensión de la metilación en la región promotora del gen receptor de glucocorticoides. Inmediatamente después del nacimiento, Meaney y Szyf encontraron que los grupos metilo reprimen el gen del receptor glucocorticoide en todos los cachorros de rata, haciendo que el gen no pueda desenrollarse de la histona para ser transcritos, causando una disminución de la respuesta al estrés. Los comportamientos estimulantes de la rata madre estimularon la activación de las vías de señalización del estrés que eliminan los grupos metilo del ADN. Esto libera el gen herido herida, exponiéndolo para la transcripción. El gen glucocorticoide se activa, dando como resultado una reducción de la respuesta al estrés. Los cachorros de rata que reciben una crianza menos nutritiva son más sensibles al estrés a lo largo de su vida.
Este trabajo pionero en roedores ha sido difícil de replicar en los seres humanos debido a una falta general de disponibilidad de tejido cerebral humano para la medición de los cambios epigenéticos.
Investigación sobre epigenética en la psicología
Ansiedad y toma de riesgos

En un pequeño estudio clínico en seres humanos publicado en 2008, diferencias epigenéticas se vincularon a las diferencias en la toma de riesgos y las reacciones al estrés en monocigóticos gemelos. El estudio identificó a gemelos con diferentes trayectorias de vida, en las que un gemelo mostraba comportamientos de riesgo y el otro mostraba comportamientos aversos al riesgo. Diferencias epigenéticas en la metilación del ADN de las islas CpG proximal al gen DLX1 correlacionado con el comportamiento diferente. Los autores del estudio gemelo observaron que a pesar de las asociaciones entre los marcadores epigenéticos y los rasgos de la personalidad de las diferencias, la epigenética no puede predecir procesos de toma de decisión complejos como la selección de la carrera.
Estrés
Los estudios en animales y humanos han encontrado correlaciones entre el mal cuidado durante la infancia y los cambios epigenéticos que se correlacionan con los impedimentos a largo plazo que resultan de la negligencia.
Los estudios en ratas han demostrado correlaciones entre la atención materna en términos de la pereza de los hijos y los cambios epigenéticos. Un alto nivel de lamer resultados en una reducción a largo plazo en la respuesta al estrés medido de forma conductual y bioquímica en elementos del eje hipotalámico-hipofisario-adrenal (HPA). Además, se observó una disminución de la metilación del gen del receptor de glucocorticoides en descendientes que experimentaron un alto nivel de lamer; El receptor glucorticoide desempeña un papel clave en la regulación de la HPA. Lo contrario se encuentra en la descendencia que experimentó niveles bajos de lamer, y cuando los cachorros se cambian, los cambios epigenéticos se invierten. Esta investigación proporciona evidencia de un mecanismo epigenético subyacente. Otro apoyo viene de los experimentos con la misma configuración, el uso de fármacos que pueden aumentar o disminuir la metilación. Finalmente, las variaciones epigenéticas en el cuidado de los padres pueden transmitirse de una generación a la siguiente, de la madre a la descendencia femenina.

En los seres humanos, un pequeño estudio clínico de investigación mostró la relación entre la exposición prenatal al estado de ánimo materno y la expresión genética, resultando en una mayor reactividad al estrés en la descendencia. Se examinaron tres grupos de lactantes: los nacidos de madres medicadas para la depresión con inhibidores de la recaptación de serotonina; Los nacidos de madres deprimidas que no están siendo tratados para la depresión; Y los nacidos de madres no deprimidas. La exposición prenatal al estado de ánimo deprimido / ansioso se asoció con el aumento de la metilación del ADN en el gen del receptor glucocorticoide y al aumento de la reactividad del estrés eje HPA. Los resultados fueron independientes de si las madres estaban siendo tratadas farmacéuticamente para la depresión.
Recientes investigaciones también han mostrado la relación de la metilación del receptor de glucocorticoides maternos y la actividad neural materna en respuesta a las interacciones madre-niño en el video. El seguimiento longitudinal de los lactantes será importante para comprender el impacto de la atención temprana en esta población de alto riesgo sobre la epigenética y el comportamiento de los niños.
Pscicopatología y salud mental
Adicción a las drogas
Influencias ambientales y epigenéticas parecen trabajar juntos para aumentar el riesgo de adicción. Por ejemplo, se ha demostrado que el estrés ambiental aumenta el riesgo de abuso de sustancias. En un intento de hacer frente al estrés, el alcohol y las drogas pueden utilizarse como escape. Una vez que el abuso de sustancias comienza, sin embargo, las alteraciones epigenéticas pueden exacerbar aún más los cambios biológicos y de comportamiento asociados con la adicción.
Incluso el abuso a corto plazo de la sustancia puede producir cambios epigenéticos duraderos en el cerebro de roedores, vía la metilación del ADN y la modificación de la histona. Se han observado modificaciones epigenéticas en estudios sobre roedores que implican etanol, nicotina, cocaína, anfetamina, metanfetamina y opiáceos. Específicamente, estos cambios epigenéticos modifican la expresión de los genes, lo que a su vez aumenta la vulnerabilidad de un individuo a participar en la sobredosis de sustancia repetida en el futuro. A su vez, el aumento del abuso de sustancias resulta en cambios epigenéticos aún mayores en varios componentes del sistema de recompensas de un roedor (por ejemplo, en el núcleo accumbens ). Por lo tanto, surge un ciclo por el cual los cambios en las áreas de placer-recompensa contribuyen a los cambios neuronales y conductuales duraderos asociados con la mayor probabilidad de adicción, el mantenimiento de la adicción y la recaída. En los seres humanos, el consumo de alcohol ha demostrado producir cambios epigenéticos que contribuyen al aumento del deseo de alcohol. Como tal, las modificaciones epigenéticas pueden desempeñar un papel en la progresión de la ingesta controlada a la pérdida de control del consumo de alcohol. Estas alteraciones pueden ser a largo plazo, como se evidencia en los fumadores que todavía poseen cambios nicotínicos relacionados con la epigenética diez años después de la cesación. [44] Por lo tanto, las modificaciones epigenéticas pueden explicar algunos de los cambios de comportamiento generalmente asociados con la adicción. Estos incluyen: hábitos repetitivos que aumentan el riesgo de enfermedad, y problemas personales y sociales; necesidad de gratificación inmediata; altas tasas de recaída después del tratamiento y la sensación de pérdida de control.
La evidencia de los cambios epigenéticos relacionados ha provenido de estudios en humanos que involucran alcohol, nicotina y abuso de opiáceos. La evidencia de los cambios epigenéticos derivados del abuso de anfetaminas y cocaína se deriva de estudios en animales. En los animales, también se ha demostrado que los cambios epigenéticos relacionados con el fármaco en los padres afectan negativamente a la descendencia en términos de menor memoria espacial de trabajo, disminución de la atención y disminución del volumen cerebral.
Trastorno bipolar
La evidencia de modificaciones epigenéticas para el trastorno bipolar aún no está clara. Un estudio encontró hipometilación de un promotor genético de una enzima lóbulo prefrontal (es decir, catecol-O-metiltransferasa unida a membrana, o COMT) en muestras cerebrales post mortem de individuos con trastorno bipolar. COMT es una enzima que metaboliza la dopamina en la sinapsis. Estos hallazgos sugieren que la hipometilación del promotor da como resultado una sobreexpresión de la enzima. A su vez, esto resulta en una mayor degradación de los niveles de dopamina en el cerebro. Estos hallazgos proporcionan evidencia de que la modificación epigenética en el lóbulo prefrontal es un factor de riesgo para el trastorno bipolar. Sin embargo, un segundo estudio no encontró diferencias epigenéticas en los cerebros post mortem de individuos bipolares.
Trastorno depresivo mayor
Las causas del trastorno depresivo mayor (MDD) son mal entendidas desde la perspectiva de la neurociencia. Los cambios epigenéticos que condujeron a cambios en la expresión de los receptores de glucocorticoides y su efecto sobre el sistema de estrés HPA discutido anteriormente, también se han aplicado a los intentos de entender MDD.
Gran parte del trabajo en modelos animales se ha centrado en la regulación negativa indirecta del factor neurotrófico derivado del cerebro (BDNF) mediante la sobreactivación del eje de tensión. Los estudios en varios modelos de roedores de depresión, que con frecuencia implican la inducción del estrés, han encontrado la modulación epigenética directa del BDNF también.
Psicopatía
La epigenética puede ser relevante para los aspectos de comportamiento psicopático a través de la metilación y la modificación de las histonas. Estos procesos son heredables pero también pueden ser influenciados por factores ambientales como el tabaquismo y el abuso. La epigenética puede ser uno de los mecanismos a través del cual el medio ambiente puede afectar la expresión del genoma. Los estudios también han vinculado la metilación de los genes asociados con la nicotina y la dependencia del alcohol en las mujeres, ADHD, y el abuso de drogas. Es probable que la regulación epigenética, así como la metilación de perfiles desempeñará un papel cada vez más importante en el estudio del juego entre el medio ambiente y la genética de los psicópatas.
Suicidio
Un estudio de los cerebros de 24 suicidas, 12 de los cuales tenían antecedentes de abuso infantil y 12 que no lo hicieron, encontraron disminución de los niveles de receptores de glucocorticoides en las víctimas de abuso infantil y los cambios epigenéticos asociados.
Limitaciones y dirección futura
Muchos investigadores aportan información al Human Epigenome Consortium. El objetivo de la investigación futura es reprogramar los cambios epigenéticos para ayudar con la adicción, la enfermedad mental, los cambios relacionados con la edad, la disminución de la memoria y otros temas. Sin embargo, el gran volumen de datos basados en el consorcio dificulta el análisis. La mayoría de los estudios también se centran en un gen. En realidad, muchos genes e interacciones entre ellos probablemente contribuyen a las diferencias individuales en la personalidad, el comportamiento y la salud. Como los científicos sociales suelen trabajar con muchas variables, la determinación del número de genes afectados también plantea retos metodológicos. Se ha propugnado una mayor colaboración entre investigadores médicos, genetistas y científicos sociales para aumentar los conocimientos en este campo de estudio.
El acceso limitado al tejido cerebral humano plantea un reto a la realización de investigaciones humanas. Todavía no se sabe si los cambios epigenéticos en la sangre y los tejidos (no cerebrales) modificaciones paralelas en el cerebro, coloca aún mayor confianza en la investigación del cerebro. Aunque algunos estudios epigenéticos han traducido hallazgos de animales a humanos, algunos investigadores advierten sobre la extrapolación de estudios en animales a humanos. Una observación señala que cuando los estudios en animales no consideran cómo los componentes subcelulares y celulares, los órganos y todo el individuo interactúan con las influencias del medio ambiente, los resultados son demasiado reductivos para explicar el comportamiento.
Algunos investigadores señalan que es probable que las perspectivas epigenéticas se deben incorporar a los tratamientos farmacológicos. Otros advierten que se necesita más investigación porque se sabe que los fármacos modifican la actividad de múltiples genes y, por lo tanto, pueden causar efectos secundarios graves. Sin embargo, el objetivo final es encontrar patrones de cambios epigenéticos que puedan ser dirigidos a tratar la enfermedad mental, y revertir los efectos de los factores estresantes de la infancia, por ejemplo. Si estos patrones tratables eventualmente se establecen bien, la incapacidad de acceder a los cerebros en humanos vivos para identificarlos plantea un obstáculo para el tratamiento farmacológico. La investigación futura también puede centrarse en los cambios epigenéticos que median el impacto de la psicoterapia en la personalidad y el comportamiento.
La mayoría de la investigación epigenética es correlacional; Simplemente establece asociaciones, por lo que es necesaria una investigación más experimental para ayudar a establecer la causalidad. La falta de recursos también ha limitado el número de estudios intergeneracionales, por lo tanto, avanzar de manera longitudinal y multigeneracional ha complicado. La experiencia en estudios posteriores será fundamental para comprender mejor el papel de la epigenética en la psicología.
Referencias
- ^ Miller G (Jul 2010). "Epigenetics. The seductive allure of behavioral epigenetics". Science. 329 (5987): 24–7. Bibcode:2010Sci...329...24M. doi:10.1126/science.329.5987.24. PMID 20595592.
- ^ Powledge T (2011). "Behavioral epigenetics: How nurture shapes nature". BioScience. 61 (8): 588–592. doi:10.1525/bio.2011.61.8.4.
- ^ Kail RV, Barnfield A (2011). Children and Their Development, Second Canadian Edition with MyDevelopmentLab. Toronto: Pearson Education Canada. ISBN 978-0-13-255770-2.
- ^ Ma DK, Marchetto MC, Guo JU, Ming GL, Gage FH, Song H (Nov 2010). "Epigenetic choreographers of neurogenesis in the adult mammalian brain". Nature Neuroscience. 13(11): 1338–44. doi:10.1038/nn.2672. PMC 3324277. PMID 20975758.
- ^ Bird A (May 2007). "Perceptions of epigenetics". Nature. 447 (7143): 396–8. Bibcode:2007Natur.447..396B. doi:10.1038/nature05913. PMID 17522671.
- ^ Mehler MF (Dec 2008). "Epigenetic principles and mechanisms underlying nervous system functions in health and disease". Progress in Neurobiology. 86 (4): 305–41. doi:10.1016/j.pneurobio.2008.10.001. PMC 2636693. PMID 18940229.