Epulopiscium
Epulopiscium es un género de bacterias grampositivas que tienen una relación simbiótica con el pez cirujano. Estas bacterias son conocidas por su tamaño inusualmente grande, muchas de las cuales oscilan entre 200 y 700 μm de longitud. Hasta el descubrimiento de las bacterias Thiomargarita en 1999, se pensaba que las bacterias Epulopiscium eran las bacterias más grandes.[1][2]
| Epulopiscium | ||
|---|---|---|
 | ||
| Taxonomía | ||
| Dominio: | Bacteria | |
| Filo: | Firmicutes | |
| Clase: | Clostridia | |
| Orden: | Clostridiales | |
| Género: | Epulopiscium | |
| Especie: |
Epulopiscium fishelsonii Montgomery&Pollak, 1999 | |
Además de su gran tamaño, los Epulopiscium, comúnmente denominados "épulos", son morfológicamente diversos y extremadamente poliploides. Los épulos también tienen estrategias reproductivas únicas en las que ciertas células pueden formar descendencia intracelular, similar a la esporulación microbiana; además, varias morfologías de épulo exhiben esporulación.[3]
Si bien las bacterias no se han cultivado con éxito en el laboratorio, los científicos han obtenido una mejor comprensión de Epulopiscium a través de análisis microscópicos, filogenéticos y genómicos.
Denominación y descubrimiento
Epulopiscium significa "invitado a un banquete de pescado" en latín, de epulum ("invitado a un banquete" o "invitado a un banquete") y piscium ("de un pez"), ya que el organismo se encontró dentro el intestino del pez cirujano marino. Las células de Epulopiscium se clasificaron inicialmente como protistas sobre la base de su gran tamaño y ultraestructura inusual.[4]
Originalmente, se pensó que las poblaciones de Epulopiscium eran una sola especie y Montgomery (uno de los codescubridores) y Pollak le dieron el nombre de Epulopiscium fishelsoni en 1988. El epíteto fishelsoni honra a Lev Fishelson, un ictiólogo israelí nacido en Polonia que formó parte del grupo que hizo el descubrimiento mientras estudiaba los intestinos de un pez cirujano marrón del Mar Rojo en 1985.[5]
Más tarde, sin embargo, Angert y sus colaboradores demostraron que Epulopiscium fishelsoni comprende dos grupos filogenéticamente distintos de bacterias utilizando comparaciones de secuencias de genes de ARNr. Estudios posteriores ilustraron la relación entre estos simbiontes y el pez cirujano anfitrión.[1]
Morfología
Las células más grandes de Epulopiscium se pueden ver a simple vista. Sin embargo, debido a su tamaño, las células de Epulopiscium deben compensar su pequeña relación superficie-volumen, en comparación con otras bacterias. Una característica distintiva es la membrana celular, que contiene muchos pliegues para aumentar el área de superficie efectiva.[6]
Además, las células de Epulopiscium son extremadamente poliploides, con individuos que contienen cientos de miles de copias del genoma. Dado que las bacterias dependen de la difusión en lugar del transporte del citoesqueleto como en los eucariotas, esta poliploidía extrema permite la producción de productos génicos en numerosos sitios de la célula para producir biomoléculas donde se necesitan.[7].
Reproducción
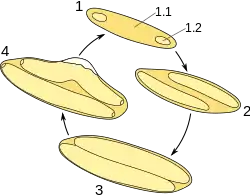
Las morfologías de Epulopiscium más grandes exhiben una reproducción vivípara única. Esta forma inusual y derivada de esporulación produce entre una y doce células hijas que crecen dentro de la célula madre, hasta que la madre finalmente se lisa y muere. Estas células parecen no utilizar la fisión binaria para reproducirse. Algunas morfologías utilizan la formación de endosporas para la reproducción. Sin embargo, hay algunas morfologías más pequeñas que se reproducen a través de la fisión binaria y la formación de esporas.[8][9]
Aunque la esporulación está muy extendida entre otras bacterias (como Bacillus y Clostridium) en el filo Firmicutes, la formación de esporas generalmente se produce por el hacinamiento, la acumulación de toxinas en el medio ambiente o la inanición, en lugar de una forma estándar de reproducción. La producción de múltiples endosporas se ha observado en otros simbiontes intestinales grandes como Metabacterium, que están filogenéticamente relacionados con Epulopiscium. Dado que la esporulación brinda a las bacterias mucha más protección del entorno exterior que la fisión binaria, se cree que la evolución de este ciclo de vida inusual puede ayudar a la transferencia de bacterias de un huésped a otro.[10]
Simbiosis
Se sugiere que los individuos de Epulopiscium y sus huéspedes, los peces cirujanos, tienen una relación simbiótica nutricional: las especies de Epulopiscium solo se han encontrado en peces cirujanos que comen algas y detritos. Se sugiere que las bacterias Epulopiscium ayuden en la digestión de los peces. Sin embargo, los científicos no han podido cultivar a Epulopiscium fuera de su hábitat natural.[11]
Referencias
- Angert ER, Clements KD, Pace NR (1993). «The largest bacterium». Nature 362 (6417): 239-241. Bibcode:1993Natur.362..239A. PMID 8459849. S2CID 4242187. doi:10.1038/362239a0.
- Angert ER, Brooks AE, Pace NR (1996). «Phylogenetic analysis of Metabacterium polyspora: Clues to the evolutionary origin of Epulopiscium spp., the largest bacteria». Journal of Bacteriology 178 (5): 1451-6. PMC 177821. PMID 8631724. doi:10.1128/jb.178.5.1451-1456.1996.
- Hutchison, Elizabeth; Yager, Nicholas A.; Taw, May N.; Taylor, Matthew; Arroyo, Francine; Sannino, David R.; Angert, Esther R. (2018). «Developmental stage influences chromosome segregation patterns and arrangement in the extremely polyploid, giant bacterium Epulopiscium sp. type B». Molecular Microbiology 107 (1): 68-80. ISSN 1365-2958. PMID 29024073. doi:10.1111/mmi.13860.
- Prescott, Lansing M.; Sherwood, Linda M.; Woolverton, Christopher J. (2006). «Procaryotic Cell Structureand Function». Microbiology. p. 43. Archivado desde el original
|urlarchivo=requiere|url=(ayuda) el 27 de septiembre de 2015. Consultado el 23 de abril de 2022. - Goren, Menachem (2013). «Professor Lev Fishelson, renowned and respected biologist 1923-2013». Israel Journal of Ecology & Evolution 59 (3): 164. doi:10.1080/15659801.2013.899808.
- Flint JF, Drzymalski D, Montgomery WL, Southam G, Angert ER (2005). «Nocturnal production of endospores in natural populations of Epulopiscium-like surgeonfish symbionts». Journal of Bacteriology 187 (21): 7460-7470. PMC 1272977. PMID 16237029. doi:10.1128/JB.187.21.7460-7470.2005.
- Angert, Esther R.; Choat, J. Howard; Clements, Kendall D.; Mendell, Jennifer E. (6 de mayo de 2008). «Extreme polyploidy in a large bacterium». Proceedings of the National Academy of Sciences 105 (18): 6730-6734. ISSN 0027-8424. PMC 2373351. PMID 18445653. doi:10.1073/pnas.0707522105.
- Angert ER, Clements KD (2004). «Initiation of intracellular offspring in Epulopiscium». Molecular Microbiology 51 (3): 827-835. PMID 14731282. S2CID 19426788. doi:10.1046/j.1365-2958.2003.03869.x.
- «Binary Fission and other Forms of Reproduction in Bacteria: Intracellular offspring production by some Firmicutes». Epulopiscium Website. Cornell Dept. of Microbiology.
- Angert, Esther R. (March 2005). «Alternatives to binary fission in bacteria». Nature Reviews. Microbiology 3 (3): 214-224. ISSN 1740-1526. PMID 15738949. S2CID 8295873. doi:10.1038/nrmicro1096.
- Pollak, Peggy E.; Montgomery, W. Linn (1 de agosto de 1994). «Giant bacterium (Epulopiscium fishelsoni) influences digestive enzyme activity of an herbivorous surgeonfish (Acanthurus nigrofuscus)». Comparative Biochemistry and Physiology Part A: Physiology 108 (4): 657-662. ISSN 0300-9629. doi:10.1016/0300-9629(94)90352-2.