Ernest Rutherford
Ernest Rutherford, conocido también como Lord Rutherford (Reino Unido: /'ɜːnɪst 'rʌðəfəd/; Brightwater, 30 de agosto de 1871-Cambridge, 19 de octubre de 1937),[1] fue un físico neozelandés.
Se dedicó al estudio de las partículas radiactivas y logró clasificarlas en alfa (α), beta (β) y gamma (γ). Halló que la radiactividad iba acompañada por una desintegración de los elementos, lo que le valió para ganar el Premio Nobel de Química en 1908. Se le debe un modelo atómico, con el que probó la existencia del núcleo atómico, en el que se reúne toda la carga positiva y casi toda la masa del átomo. Consiguió la primera transmutación artificial con la colaboración de su discípulo Frederick Soddy (Soddy recibió más tarde en su carrera también el Premio Nobel de Química en 1921 por sus trabajos sobre isótopos).
Durante la primera parte de su vida se consagró por completo a la investigación, y pasó la segunda mitad dedicado a la docencia y dirigiendo los Laboratorios Cavendish de Cambridge, en donde se descubrió el neutrón. Fue maestro, entre otros, de Niels Bohr y Otto Hahn.
Primeros años
Su padre, James, de origen escocés, era granjero y mecánico, y su madre, Martha Thompson, nacida en Inglaterra, era maestra, que había emigrado antes de casarse. Ambos deseaban dar a sus hijos una buena educación y tratar de que pudiesen proseguir sus estudios.
Rutherford destacó muy pronto por su curiosidad y su capacidad para la aritmética. Sus padres y su maestro lo animaron mucho, y resultó ser un alumno brillante, lo que le permitió entrar en el Nelson College, en el que estuvo cuatro años. También tenía grandes cualidades para el rugby, lo que le valía ser muy popular en su escuela. El último año, terminó en primer lugar en todas las asignaturas, gracias a lo que ingresó en la Universidad en Nueva Zelanda, en el Canterbury College, en el que siguió practicando el rugby y en el que participó en los clubes científicos y de reflexión. [2]
Por esa época empezó a manifestarse el genio de Rutherford para la experimentación: sus primeras investigaciones demostraron que el hierro podía magnetizarse por medio de altas frecuencias, lo que de por sí era un descubrimiento. Sus excelentes resultados académicos le permitieron proseguir sus estudios y sus investigaciones durante cinco años en total en esa Universidad. Se licenció en Christchurch y poco después consiguió la única beca de Nueva Zelanda para estudiar matemáticas, y cubrió sus gastos el último año trabajando como maestro. Obtuvo de ese modo el título de Master of Arts con las mejores calificaciones en matemáticas y física.
En 1894 obtuvo el título de Bachelor of Science, que le permitió proseguir sus estudios en Gran Bretaña, en los Laboratorios Cavendish de Cambridge, bajo la dirección del descubridor del electrón, Joseph John Thomson a partir de 1895. Fue el primer estudiante de ultramar que alcanzó esta posibilidad. Antes de salir de Nueva Zelanda, se comprometió con Mary Newton, una joven de Christchurch. En los laboratorios Cavendish, reemplazaría años más tarde a Thomson.
Cambridge, 1895-1898
ondas hertzianas y sobre su recepción a gran distancia. Hizo una extraordinaria presentación de sus trabajos ante la Cambridge Physical Society, que se publicaron en las Philosophical Transactions de la Royal Society, hecho poco habitual para un investigador tan joven, lo que le sirvió para alcanzar notoriedad.
En diciembre de 1895, empezó a trabajar con Thomson en el estudio del efecto de los rayos X sobre un gas. Descubrieron que los rayos X tenían la propiedad de ionizar el aire, puesto que pudieron demostrar que producía grandes cantidades de partículas cargadas, tanto positivas como negativas, y que esas partículas podían recombinarse para dar lugar a átomos neutros. Por su parte, Rutherford inventó una técnica para medir la velocidad de los iones y su tasa de recombinación. Estos trabajos fueron los que le condujeron por el camino a la fama.
En 1898, tras pasar tres años en Cambridge, cuando contaba con 27 años, le propusieron una cátedra de física en la Universidad McGill de Montreal, que aceptó inmediatamente,[3] ya que además la cátedra representaba para él la posibilidad de casarse con su prometida.[4][5]
Montreal, 1898-1907: radiactividad

Henri Becquerel descubrió por esa época (1896) que el uranio emitía una radiación desconocida, la "radiación uránica". Rutherford publicó en 1899 un documento esencial, en el que estudiaba el modo que podían tener esas radiaciones de ionizar el aire, situando al uranio entre dos placas cargadas y midiendo la corriente que pasaba. Estudió así el poder de penetración de las radiaciones, cubriendo sus muestras de uranio con hojas metálicas de distintos espesores. Se dio cuenta de que la ionización empezaba disminuyendo rápidamente conforme aumentaba el espesor de las hojas, pero que por encima de un determinado espesor disminuía más débilmente. Por ello dedujo que el uranio emitía dos radiaciones diferentes, puesto que tenían poder de penetración distinto. Llamó a la radiación menos penetrante radiación alfa, y a la más penetrante (y que producía necesariamente una menor ionización puesto que atravesaba el aire) radiación beta.
En 1900, Rutherford se casó con Mary Newton. De este matrimonio nació en 1901 su única hija, Eileen.
Por esa época, Rutherford estudia el torio y se da cuenta, al utilizar el mismo dispositivo que para el uranio, de que abrir una puerta en el laboratorio perturba notablemente el experimento, como si los movimientos del aire pudieran alterar el experimento. Pronto llegará a la conclusión de que el torio desprende una emanación, también radiactiva, puesto que al aspirar el aire que rodea el torio, se da cuenta de que ese aire transmite la corriente fácilmente, incluso a gran distancia del torio.
También nota que las emanaciones de torio solo permanecen radiactivas unos diez minutos y que son partículas neutras. Su radiactividad no se ve alterada por ninguna reacción química, ni por cambios en las condiciones (temperatura, campo eléctrico). Se da cuenta asimismo de que la radiactividad de esas partículas decrece exponencialmente, puesto que la corriente que pasa entre los electrodos también lo hace, y descubre así el periodo de los elementos radiactivos en 1900. Con la ayuda de un químico de Montreal, Frederick Soddy, llega en 1902 a la conclusión de que las emanaciones de torio son efectivamente átomos radiactivos, pero sin ser torio, y que la radiactividad viene acompañada de una desintegración de los elementos.
Este descubrimiento provocó un gran revuelo entre los químicos, muy convencidos del principio de indestructibilidad de la materia. Una gran parte de la ciencia de la época se basaba en este concepto. Por ello, este descubrimiento representa una auténtica revolución. Sin embargo, la calidad de los trabajos de Rutherford no dejaban margen a la duda. El mismísimo Pierre Curie tardó dos años en admitir esta idea, a pesar de que ya había constatado con Marie Curie que la radiactividad ocasionaba una pérdida de masa en las muestras. Pierre Curie opinaba que perdían peso sin cambiar de naturaleza.
Las investigaciones de Rutherford tuvieron el reconocimiento en 1903 de la Royal Society, que le otorgó la Medalla Rumford en 1904. Resumió el resultado de sus investigaciones en un libro titulado Radiactividad en 1904, en el que explicaba que la radiactividad no estaba influida por las condiciones externas de presión y temperatura, ni por las reacciones químicas, pero que comportaba una emisión de calor superior al de una reacción química. Explicaba también que se producían nuevos elementos con características químicas distintas, mientras desaparecían los elementos radiactivos.
Junto a Frederick Soddy, calculó que la emisión de energía térmica debida a la desintegración nuclear era entre 20.000 y 100.000 veces superior a la producida por una reacción química. Lanzó también la hipótesis de que tal energía podría explicar la energía desprendida por el sol. Opinaban que si la tierra conserva una temperatura constante (en lo que concierne a su núcleo), se debe sin duda a las reacciones de desintegración que se producen en su seno. Esta idea de una gran energía potencial almacenada en los átomos encontrará un año después un principio de confirmación cuando Albert Einstein descubra la equivalencia entre masa y energía. Tras estos trabajos, Otto Hahn, el descubridor de la fisión nuclear junto con Fritz Strassmann y Lise Meitner, acudirá a estudiar con Rutherford en McGill durante unos meses.
A través de numerosos estudios con elementos radiactivos observa que estos emiten dos tipos de radiación. El primer tipo de radiación, al que denomina rayos alfa, es altamente energético pero tiene poco alcance y es absorbida por el medio con rapidez. El segundo tipo de radiación es altamente penetrante y de mucho mayor alcance, al que llama rayos beta. Mediante el uso de campos eléctricos y magnéticos analiza estos rayos y deduce su velocidad, el signo de su carga y la relación entre carga y masa. También encuentra un tercer tipo de radiación muy energético, al que denominará rayos gamma.
Mánchester, 1907-1919: el núcleo atómico
En 1907, obtiene una plaza de profesor en la Universidad de Mánchester, en donde trabajará junto a Hans Geiger. Con este inventará un contador que permite detectar las partículas alfa emitidas por sustancias radiactivas (prototipo del futuro contador Geiger), ya que ionizando el gas que se encuentra en el aparato, producen una descarga que se puede detectar. Este dispositivo les permite estimar el número de Avogadro de modo muy directo: averiguando el periodo de desintegración del radio y midiendo con su aparato el número de desintegraciones por unidad de tiempo. De ese modo dedujeron el número de átomos de radio presente en la muestra.
En 1908, junto con uno de sus estudiantes, Thomas Royds, demuestra de modo definitivo lo que se suponía: que las partículas alfa son núcleos de helio. [6][7] En realidad, lo que prueban es que una vez liberadas de su carga, las partículas alfa son átomos de helio. Para demostrarlo, aisló la sustancia radiactiva en un material suficientemente delgado para que las partículas alfa lo atravesaran efectivamente, pero para ello bloquea cualquier tipo de "emanación" de elementos radiactivos, es decir, cualquier producto de la desintegración. Recoge a continuación el gas que se halla alrededor de la caja que contiene las muestras y analiza su espectro. Encuentra entonces gran cantidad de helio: los núcleos que constituyen las partículas alfa, han recuperado electrones disponibles.
Ese mismo año gana el Premio Nobel de Química por sus trabajos de 1908. Sufrirá, sin embargo, un pequeño disgusto, pues él se considera fundamentalmente un físico. Una de sus citas más famosas es que "la ciencia, o es Física, o es filatelia", con lo que sin duda situaba la física por encima de todas las demás ciencias.
En 1911 hará su mayor contribución a la ciencia, al descubrir el núcleo atómico. Había observado en Montreal al bombardear una fina lámina de mica con partículas alfa, que se obtenía una deflexión de dichas partículas. Al retomar Geiger y Marsden de modo más concienzudo estos experimentos y utilizando una lámina de oro, se dieron cuenta de que algunas partículas alfa se desviaban más de 90 grados. Rutherford lanzó entonces la hipótesis, que Geiger y Marsden enfrentaron a las conclusiones de su experimento, de que en el centro del átomo debía haber un "núcleo" que contuviera casi toda la masa [8] y toda la carga positiva del átomo, y que de hecho los electrones debían determinar el tamaño del átomo. Este modelo planetario había sido sugerido en 1904 por un japonés, Hantarō Nagaoka, aunque había pasado desapercibido. Se le objetaba que en ese caso los electrones tendrían que irradiar girando alrededor del núcleo central y, en consecuencia, caer. Los resultados demostraron que ese era sin dudar el modelo bueno, puesto que permitía prever con exactitud la tasa de difusión de las partículas alfa en función del ángulo de difusión y de un orden de magnitud para las dimensiones del núcleo atómico. Las últimas objeciones teóricas (sobre la irradiación del electrón) se desvanecieron con los principios de la teoría cuántica y la adaptación que hizo Niels Bohr del modelo de Rutherford a la teoría de Max Planck, lo que sirvió para demostrar la estabilidad del átomo de Rutherford.
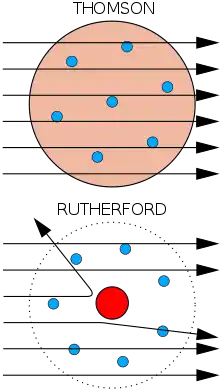
Abajo: Resultados obervados: una pequeña proporción de las partículas fueron deflectadas, lo que indica una carga concentrada pequeña, es decir el núcleo atómico. El diagrama no está a escala; en realidad el núcleo es mucho más pequeño que la capa exterior de electrones.

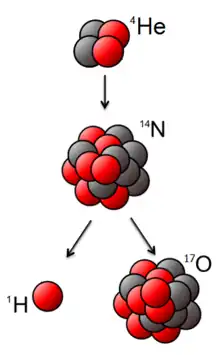
En 1914 empieza la Primera Guerra Mundial, y Rutherford se concentra en los métodos acústicos de detección de submarinos. Tras la guerra, ya en 1919, lleva a cabo su primera transmutación artificial. Después de observar los protones producidos por el bombardeo de hidrógeno de partículas alfa (al observar el parpadeo que producen en pantallas cubiertas de sulfuro de zinc), se da cuenta de que obtiene muchos de esos parpadeos si realiza el mismo experimento con aire y aún más con nitrógeno puro. Deduce de ello que las partículas alfa, al golpear los átomos de nitrógeno, han producido un protón, es decir, que el núcleo de nitrógeno ha cambiado de naturaleza y se ha transformado en oxígeno, al absorber la partícula alfa. Rutherford acababa de producir la primera transmutación artificial de la historia. Algunos opinan que fue el primer alquimista que consiguió su objetivo.
Cambridge, 1919-1937: la edad de oro en Cavendish
Ese mismo año sucede a J. J. Thomson en el laboratorio Cavendish, pasando a ser el director. Es el principio de una edad de oro para el laboratorio y también para Rutherford. A partir de esa época, su influencia en la investigación en el campo de la física nuclear es enorme. Por ejemplo, en una conferencia que pronuncia ante la Royal Society, ya alude a la existencia del neutrón y de los isótopos del hidrógeno y del helio. Y estos se descubrirán en el laboratorio Cavendish, bajo su dirección. James Chadwick, descubridor del neutrón (Premio Nobel en 1932 por esto), Niels Bohr, que demostró que el modelo planetario de Rutherford no era inestable, y Robert Oppenheimer, al que se considera el padre de la bomba atómica, están entre los que estudiaron en el laboratorio en los tiempos de Rutherford. Moseley, que fue alumno de Rutherford, demostró, utilizando la desviación de los rayos X, que los átomos contaban con tantos electrones como cargas positivas había en el núcleo, y que de ello resultaba que sus resultados «confirmaban con fuerza las intuiciones de Bohr y Rutherford». John Cockcroft y Ernest Walton recibieron el Premio Nobel en 1938 por un experimento demostrando la desintegración del átomo utilizando un acelerador de partículas,[9] y Edward Appleton también recibió el Premio Nobel, en 1947, por la demostración de la existencia de la ionosfera. [10]
El gran número de clases que dio en el laboratorio Cavendish y la gran cantidad de contactos que tuvo con sus estudiantes dio una imagen de Rutherford como una persona muy apegada a los hechos, más aún que a la teoría, que para él solo era parte de una «opinión». Este apego a los hechos experimentales era el indicio de un gran rigor y de una gran honestidad. Cuando Enrico Fermi consiguió desintegrar diversos elementos con la ayuda de neutrones, le escribió para felicitarle por haber conseguido «escapar de la física teórica».
Por fortuna, Rutherford no se detenía en los hechos, y su gran imaginación le dejaba entrever, más allá, las consecuencias teóricas más lejanas, pero no podía aceptar que se complicaran las cosas inútilmente. Con frecuencia hacía observaciones en este sentido a los visitantes del laboratorio que venían a exponer sus trabajos a los estudiantes y a los investigadores, cualquiera que fuera la fama del visitante. Su apego a la simplicidad era casi proverbial. Como él mismo decía: «Yo mismo soy un hombre sencillo».
Su autoridad en el laboratorio Cavendish no se basaba en el temor que pudiera inspirar. Por el contrario, Rutherford tenía un carácter jovial. Se sabía que estaba avanzando en sus trabajos cuando se le oía canturrear en el laboratorio. Sus alumnos lo respetaban mucho, no tanto por sus pasados trabajos o por el mito que le rodeaba como por su atractiva personalidad, su generosidad y su autoridad intelectual. Su discípulo ruso Peter Kapitza le apodó "el cocodrilo" y así era conocido entre sus colegas. No porque fuera temible o peligroso, sino porque para un soviético tan lejano de los ríos africanos, el concepto de cocodrilo representaba una tremenda fuerza. Aunque nadie le llamare así de frente, Rutherford lo sabía bien y se enorgullecía en secreto. Es más, el edificio construido para los estudios de Kapitza tenía un gran bajorrelieve de un cocodrilo.[11]
También esta es para Rutherford la época de los honores: fue presidente de la Royal Society entre 1925 y 1930, y chairman de la Academic Assistance Council, que en esos políticamente turbulentos tiempos ayudaba a los universitarios alemanes que huían de su país. También se le concedió la Medalla Franklin en 1924 y de la Medalla Faraday en 1936. Realizó su último viaje a Nueva Zelanda, su país natal, que nunca olvidó, en 1925 y fue recibido como un héroe. Alcanzó la nobleza en 1931 y obtuvo el título de Barón Rutherford de Nelson, de Cambridge. Pero ese mismo año murió su única hija, Eileen, nueve días después de haber dado a luz a su cuarto hijo.
Rutherford era un hombre muy robusto y entró en el hospital en 1937 para someterse a una operación menor, tras haberse herido podando unos árboles de su propiedad. Al regresar a casa, parecía recuperarse sin problemas, pero su estado se agravó repentinamente. Murió el 19 de octubre[1] y se le enterró en la abadía de Westminster, junto a Isaac Newton y Kelvin.
Legado
Rutherford está considerado como uno de los mayores científicos de la historia.
Las investigaciones de Rutherford, y los trabajos realizados bajo su dirección como director del laboratorio, establecieron la estructura nuclear del átomo y la naturaleza esencial de la desintegración radiactiva como proceso nuclear. Patrick Blackett, un investigador que trabajaba bajo las órdenes de Rutherford, demostró, utilizando partículas alfa naturales, la transmutación nuclear inducida. Posteriormente, el equipo de Rutherford, utilizando protones de un acelerador, demostró las reacciones nucleares y la transmutación inducidas artificialmente. Se le conoce como el padre de la física nuclear. Rutherford murió demasiado pronto para ver cómo se materializaba la idea de reacción nuclear en cadena de Leó Szilárd. Sin embargo, un discurso de Rutherford sobre su transmutación inducida artificialmente en el litio, publicado en el periódico londinense The Times del 12 de septiembre de 1933, fue señalado por Szilárd como su inspiración para pensar en la posibilidad de una reacción nuclear en cadena controlada que produjera energía. Szilard tuvo esta idea mientras paseaba por Londres, ese mismo día.
El discurso de Rutherford se refirió a los trabajos realizados en 1932 por sus estudiantes John Cockcroft y Ernest Walton para "dividir" el litio en partículas alfa mediante el bombardeo con protones de un acelerador de partículas que habían construido. Rutherford se dio cuenta de que la energía liberada por los átomos de litio divididos era enorme, pero también se dio cuenta de que la energía necesaria para el acelerador, y su ineficiencia esencial para dividir átomos de esta manera, hacían que el proyecto fuera una imposibilidad como fuente práctica de energía (la fisión inducida por el acelerador de elementos ligeros sigue siendo demasiado ineficiente para ser utilizada de esta manera, incluso hoy en día). El discurso de Rutherford, en parte, decía
Podríamos obtener en estos procesos mucha más energía de la que proporcionaba el protón, pero en general no podríamos esperar obtener energía de esta manera. Era una forma muy pobre e ineficaz de producir energía, y cualquiera que buscara una fuente de energía en la transformación de los átomos estaba en la luna. Pero el tema era científicamente interesante porque permitía conocer los átomos por dentro.[12]
Publicaciones principales
- Radio-activity (Cambridge University Press, 1904), (Reeditado por Dover Phoenix Editions en 2005, ISBN 0-486-49585-X)
- Radioactive Transformations (1906), (Reeditado por Juniper Grove en 2007, ISBN 1-60355-054-2)
- Radiations from Radioactive Substances (1919). Disponible en: https://archive.org/details/radioactivesubst00ruthuoft
- The Electrical Structure of Matter (1926)
- The Artificial Transmutation of the Elements (1933)
- The Newer Alchemy (1937)
Eponimia

.
- El cráter lunar Rutherford lleva este nombre en su memoria.[13]
- El cráter marciano Rutherford igualmente conmemora su nombre.[14]
- El asteroide (1249) Rutherfordia recibió este nombre en su honor.[15]
- El Rutherfordio lleva su nombre en memoria del científico
Premio Nobel
| Predecesor: Eduard Buchner |
Premio Nobel de Química 1908 |
Sucesor: Wilhelm Ostwald |
Rutherford recibió el Premio Nobel de Química de 1908 en reconocimiento a «sus investigaciones en la desintegración de los elementos y en la química de las sustancias radioactivas».[16]
Entre otras distinciones, fue elegido miembro (1903) y presidente (1925-1930) de la Royal Society de Londres, y se le concedieron los títulos de sir en 1914 y de barón Rutherford of Nelson en 1931.
El elemento 104 de la tabla periódica se denomina Rutherfordio en su honor.
A su muerte, sus restos mortales fueron inhumados en la abadía de Westminster.
Notas y referencias
- «Ernest Rutherford - Facts». The Nobel Prize in Chemistry 1908 (en inglés). Consultado el 28 de noviembre de 2021.
- Campbell, John (30 de octubre de 2012). «Rutherford, Ernest». An Encyclopaedia of New Zealand (en inglés) (Te Ara – The Encyclopaedia of New Zealand). Consultado el 1 de octubre de 2013.
- McKown, Robin (1962). Giant of the Atom, Ernest Rutherford (en inglés). Julian Messner Inc, New York. p. 57.
- TEARA:The Encyclopedia of New Zealand Story: Rutherford, Ernest
- Birth, Death and Marriage Historical Records, New Zealand Government Registration number 1954/19483
- Campbell, John. «Rutherford – A Brief Biography». Rutherford.org.nz (en inglés). Consultado el 4 de marzo de 2013.
- Rutherford, E.; Royds, T. (1908). «Spectrum of the radium emanation». Philosophical Magazine. Series 6 (en inglés) 16 (92): 313. doi:10.1080/14786440808636511.
- Longair, M. S. (2003). Theoretical concepts in physics: an alternative view of theoretical reasoning in physics (en inglés). Cambridge University Press. pp. 377-378. ISBN 978-0-521-52878-8.
- "for their discovery that nuclei could be disintegrated by artificially produced bombarding particles". Mehra, Jagdish (2001). The Historical Development of Quantum Theory. Springer. p. 36. ISBN 0-387-96284-0.
- «Edward V. Appleton - Biographical». Nobel Prizes and Laureates (en inglés). Consultado el 25 de febrero de 2018.
- Gamov, George. Biografía de la física. Salvat. 1971, pp. 179-180
- The Times archives, 12 de septiembre de 1933, "The British association - breaking down the atom"
- «Crater lunar Rutherford». Gazetteer of Planetary Nomenclature (en inglés). Flagstaff: USGS Astrogeology Research Program. OCLC 44396779.
- «Crater marciano Rutherford». Gazetteer of Planetary Nomenclature (en inglés). Flagstaff: USGS Astrogeology Research Program. OCLC 44396779.
- «Datos de la NASA (JPL Small-Body Database Browser)». Consultado el 29 de abril de 2015.
- «The Nobel Prize in Chemistry 1908». Nobelprize.org. Consultado el 22 de octubre de 2010.
Bibliografía
- Cragg, R. H. (1971). «Lord Ernest Rutherford of Nelson (1871-1937)». Royal Institute of Chemistry, Reviews (en inglés) 4 (2): 129. doi:10.1039/RR9710400129.
- Campbell, John. (1999) Rutherford: Scientist Supreme, AAS Publications, Christchurch, ISBN 0-4730-5700-X (en inglés)
- Marsden, E. (1954). «The Rutherford Memorial Lecture, 1954. Rutherford-His Life and Work, 1871-1937». Proceedings of the Royal Society A (en inglés) 226 (1166): 283-305. Bibcode:1954RSPSA.226..283M. S2CID 73381519. doi:10.1098/rspa.1954.0254.
- Reeves, Richard (2008). A Force of Nature: The Frontier Genius of Ernest Rutherford. New York: W. W. Norton. ISBN 0-393-33369-8 (en inglés)
- Rhodes, Richard (1986). La fabricación de la bomba atómica. New York: Simon & Schuster. ISBN 0-671-44133-7 (en inglés)
- Wilson, David (1983). Rutherford. Simple Genius, Hodder & Stoughton, ISBN 0-340-23805-4 (en inglés)
Enlaces externos
.jpg.webp)
 Wikimedia Commons alberga una galería multimedia sobre Ernest Rutherford.
Wikimedia Commons alberga una galería multimedia sobre Ernest Rutherford. Wikiquote alberga frases célebres de o sobre Ernest Rutherford.
Wikiquote alberga frases célebres de o sobre Ernest Rutherford.- Biografías y Vidas: Ernest Rutherford
- Explicación del pensamiento químico de Rutherford

