Esquema de desintegración
El esquema de desintegración de una sustancia radiactiva es una representación gráfica de todas las transiciones que ocurren durante su decaimiento, y de sus interrelaciones.
Esquemas de desintegración de isotopos radiactivos

Estas interrelaciones pueden ser complejas; a modo de ejemplo se esquematiza la desintegración del isótopo radiactivo Cobalto-60.[1] El 60Co se desintegra emitiendo un electrón (desintegración beta con un periodo de semidesintegración (o semivida) de 5,26 años en un estado excitado del 60Ni, que luego decae muy rápidamente, mediante la emisión de dos rayos gamma, al estado fundamental del 60Ni.
Puede resultar de utilidad pensar que el esquema de desintegración se encuentra en un sistema de coordenadas, donde en el eje de ordenadas se representa la energía, incrementándose en dirección ascendente, y en el de abscisas el número atómico, incrementándose de izquierda a derecha. Las flechas indican el tipo de partícula emitida. Para el decaimiento gamma (flechas verticales), se indica la energía de los fotones gamma; para la desintegración beta (flechas oblicuas), la energía máxima que puede adquirir la partícula.
El níquel se representa a la derecha del cobalto dado que su número atómico (28) es mayor que el del cobalto (27). En la desintegración beta, el número atómico varía en una unidad. Para el decaimiento positrónico y también para la desintegración alfa (ver a continuación), la flecha oblicua se dibuja de derecha a izquierda ya que en ambos casos el número atómico disminuye.
Dado que la energía se conserva y ya que las partículas emitidas adquieren energía, las flechas solo pueden dibujarse en dirección descendente en un esquema de desintegración.
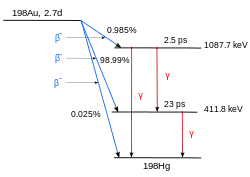
Este esquema resulta ligeramente más complejo: el decaimiento del nucleido 198Au[2] que puede ser producido irradiando isótopos estables del oro en un reactor nuclear. El 198Au se desintegra por decaimiento beta a uno de dos estados excitados o al estado fundamental del isótopo 198 del mercurio. En la figura, el mercurio se encuentra a la derecha del oro dado que su número atómico es 80, mientras que el del oro es 79. Los estados excitados decaen muy rápidamente (2,5 y 23 picosegundos respectivamente) al estado fundamental.

Mientras que los estados nucleares excitados son en general de muy corta vida, decayendo prácticamente en forma inmediata luego de ser originados por una desintegración beta previa, el estado excitado del isótopo del tecnecio mostrado a la derecha posee una vida de mayor duración. Se denomina, por lo tanto, estado metaestable (indicado por el superíndice "m", 99mTc[3]). Decae al estado fundamental mediante la emisión de rayos gamma, con un periodo de semidesintegración de 6 horas.
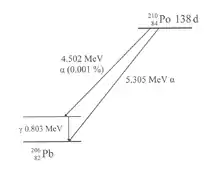
A la izquierda se esquematiza una desintegración alfa. Es el decaimiento del elemento polonio[4] descubierto por Marie Curie, con un número másico de 210. El isótopo 210Po es el penúltimo elemento de la cadena de desintegración del uranio-radio; se desintegra en un isótopo estable del plomo con un periodo de semidesintegración de 138 días. En casi todos los casos, la desintegración se da mediante la emisión de una partícula alfa de 5,305 MeV. Solo en una desintegración de cada 100 000 aparece una partícula alfa de menor energía; en este caso, la desintegración no lleva al estado fundamental sino a uno excitado del 206Pb, el cual luego decae al nivel fundamental por emisión gamma.
Referencias
- K.H.Lieser Einführung in die Kernchemie (1991) S.223, Abb. (7-22); ISBN 3-527-i28329-3
- K.H.Lieser, Nuclear and Radiochemistry (2001), p.61, Fig 5.12; ISBN 3-527-30317-0
- H.Krieger, Grundlagen der Strahlungsphysik und des Strahlenschutzes (2007), S.117, Fig 3.15; ISBN 978-3-8351-0199-9
- K.H.Lieser, Nuclear and Radiochemistry (2001), p.52, Fig 5.4; ISBN 3-527-30317-0