Estrobilurina
Las estrobilurinas son derivados naturales del ácido β-metoxiacrílico producidos por varias especies de hongos. Estos compuestos son relevantes por poseer distintas actividades biológicas, como antifúngicas, antivirales y antitumorales. Se ha establecido un modo de acción que consiste en la inhibición de la respiración mitocondrial por unión a un sitio específico en el citocromo b.[1][2]
El primer miembro de esta familia de productos naturales fue originalmente denominado mucidina, pero actualmente ese nombre se encuentra en desuso, siendo el nombre correcto para denominarla Estrobilurina A. Fue aislada en Checoslovaquia en los años 60's por Musilek y sus colaboradores a partir del cuerpo fructífero de Oudemansiella mucidu.[3]
Tipos de estrobilurinas
Hasta la fecha se han aislado 15 tipos de estrobilurinas, las cuales se ilustran en el cuadro siguiente:
| Nombre | Estructura | Punto de fusión | CAS | Abundancia natural |
|---|---|---|---|---|
| Estrobilurina A (Mucidina) | 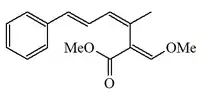 |
Oudemansiella mucida y Strobiluris tenacellus[4] | ||
| Estrobilurina B | 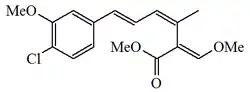 |
|||
| Estrobilurina C | 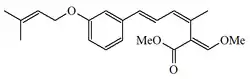 |
Xerula longipes y Xerula melanotricha[5] | ||
| Estrobilurina D |  |
Cyphellopsis anomala[6] | ||
| Hidroxistrobilurina D | 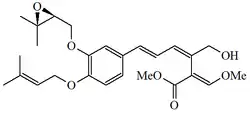 |
|||
| Estrobilurina E |  |
Crepidotus fulvotomentosus[7] | ||
| Estrobilurina F-1 | 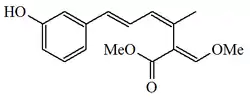 |
|||
| Estrobilurina F-2 | 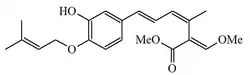 |
Bolinea lutea[8] | ||
| Estrobilurina G | 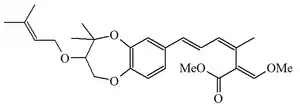 |
129145-64-8 | Bolinea lutea | |
| Estrobilurina H |  |
Bolinea lutea | ||
| Estrobilurina I |  |
|||
| Estrobilurina K | 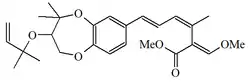 |
|||
| Estrobilurina M | 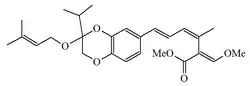 |
Mycena spp.[9] | ||
| Estrobilurina N | 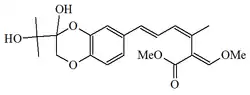 |
Mycena crocata[10] | ||
| Estrobilurina O | ||||
| Estrobilurina P | ||||
Todas contienen un grupo α-metil-β-metoxiacrilato unido a una unidad sustituida de fenilpentadienilo. Los grupos alqueno tienen la conformación E, Z, E. Los miembros de la familia de las estrobilurinas difieren unas de otras debido a los sustituyentes de las posiciones 3- y 4- del anillo de benceno, con la excepción de la hidroxistrobilurina D, la cual sólo presenta un sustituyente hidroxilo en el grupo metilo de la unidad de fenilpentadienilo. Estas moléculas varían en complejidad con respecto a la estrobilurina A.
Abundancia
Las estrobilurinas, junto con compuestos relacionados como las oudemansinas han sido descritas de 34 especies de hongos pertenecientes a 12 géneros: Agaricus, Bolinea, Crepidotus, Cyphellopsis, Favolaschia, Filoboletus, Hydropus, Mycena, Pterula, Strobilurus y Xerula.
Biosíntesis
De acuerdo a los estudios de marcaje isotópico de Bedorf y colaboradores[11] en el hongo Oudernansiella mucida, la estrobilurina A es un policétido modificado mixto, con una molécula de ácido benzoico como unidad de iniciación. Tres metilos son aportados por la S-adenosil metionina:
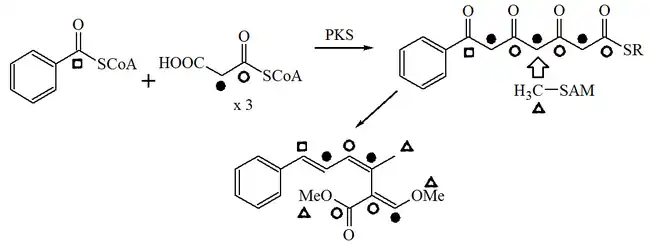
Son pocos los reportes detallados de la biosíntesis de las estrobilurinas. El marcaje isotópico indica que debe haber un paso de transposición en el extremo terminal del policétido. Sin embargo, hay evidencia de que al menos algunas estrobilurinas se forman de la estrobilurina A: el análisis de las estrobilurinas presentes en varias etapas de la fermentación de Bolinea lutea sugieren que la estrobilurina A no es estable en el cultivo líquido pero se convierte en las estrobilurinas B, F-2, G y H.
Síntesis
Steglich y colaboradores reportaron la síntesis total de la estrobilurina A por condensación aldólica del enolato del ácido 2-oxobutírico y el cinamaldehído. Posteriormente el producto se esterificó con metanol, y se efectuó una reacción de Wittig con el derivado de la trifenilfosfina con el cloruro de metoximetilo. El producto se fue sometido a luz para promover la isomería cis-trans.[12]

Fungicidas sintéticos
Las estrobilurinas constituyen prototipos estructurales que han dado pie a la síntesis de análogos con propiedades antifúngicas. Algunos ejemplos son la azoxistrobina, kresoxim-metilo, picoxistrobina, piraclostrobina y trifloxistrobina.
Estos fungicidas se utilizan en una amplia gama de cultivos, como cereales, vid, frutas de pepita, cucurbitáceas, tomates y patatas. Por ejemplo, se utilizan como fungicidas para cereales, contra Erysiphe graminis tritici spp. responsable del moho polvoso del trigo, o contra Septoria tritici, responsable de la septoriosis en la hoja del trigo. También son utilizados para la vid, contra Plasmopara viticola, responsable de mildiu y el oidium, o también en el cultivo de café para el control de la roya (Hemileia vastatrix).
Todos estos fungicidas están en el mismo grupo de resistencia cruzada (el mismo modo de acción) y deben ser administrado cuidadosamente para evitar la aparición de hongos fitopatógenos resistentes. Se ha observado en la mayoría de los cultivos alguna resistencia a los fungicidas (como en el caso del moho polvoso del trigo).
Referencias
- Anke, T.; Steglich, W. In Biologically active molecules: identification, characterisation and synthesis; Schlunegger, U. P., Ed.; Springer: Berlin, Heidelberg, 1989; pp 1–8
- The strobilurins, oudemansins, and myxothiazols, fungicidal derivatives of β-methoxyacrylic acid. J. M. Clough. Nat. Prod. Rep. (1993) 10:565-574
- V. Musilek, J. Cerna, V. SaSek, M. Semerdiieva, and M.Vondra Eek, Folia Microbiol. (Prague) (1969) 14:377.
- Mucidin and strobilurin A are identical and inhibit electron transfer in the cytochrome bc1 complex of the mitochondrial respiratory chain at the same site as myxothiazol. Von Jagow G, Gribble GW, Trumpower BL. Biochemistry (1986) 25(4):775-80
- Antibiotics from basidiomycetes. XVIII. Strobilurin C and oudemansin B, two new antifungal metabolites from Xerula species (Agaricales).Anke T, Besl H, Mocek U, Steglich W. J Antibiot (Tokyo) (1983) 36(6):661-6
- Strobilurin D and strobilurin F: two new cytostatic and antifungal (E)-beta-methoxyacrylate antibiotics from Cyphellopsis anomala (1).Weber W, Anke T, Bross M, Steglich W. Planta Med. (1990) 56(5):446-50
- Antibiotics from basidiomycetes. XXXII. Strobilurin E: a new cytostatic and antifungal (E)-beta-methoxyacrylate antibiotic from Crepidotus fulvotomentosus Peck. Weber W, Anke T, Steffan B, Steglich W. J. Antibiot (Tokyo) (1990) 43(2):207-12
- Strobilurins F, G and H, three new antifungal metabolites from Bolinea lutea. I. Fermentation, isolation and biological activity. Fredenhagen A, Kuhn A, Peter HH, Cuomo V, Giuliano U. J Antibiot (Tokyo) (1990) 43(6):655-660
- Daferner, M.; Anke, T.; Hellwig, V.; Steglich, W.; Sterner, O. J. Antibiot. (1998) 51:816–822
- Buchanan, M. S.; Steglich, W.; Anke, T. Z. Naturforsch. (1999) 54c:463–468
- N. Bedorf, B. Kunze, H. Reichenbach, and G. Hofle, Scientific Annual Report of the Gesellschaft fur Biotechnologische Forschung mbH, Braunschweig (Germany), 1986, p. 14.
- W. Steglich, G. Schramm, T. Anke, and F. Oberwinkler, Eur. Pat. EP 44448 Chem. Abstr. (1982) 96,162440c