Etilendiamina
La etilendiamina es un líquido incoloro con olor a amoníaco que se disuelve en el agua formando una disolución de pH básico. Sus vapores más pesados que el aire son inflamables y pueden producir mezclas explosivas con el aire.
| Etilendiamina | ||
|---|---|---|
| General | ||
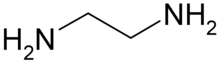
| Fórmula semidesarrollada | H2NCH2CH2NH2 | |
| Fórmula estructural |
| |
| Fórmula molecular | C2H8N2 | |
| Identificadores | ||
| Número CAS | 107-15-3[1] | |
| Número RTECS | KH8575000 | |
| ChEBI | 30347 | |
| ChEMBL | CHEMBL816 | |
| ChemSpider | 13835550 | |
| DrugBank | 14189 | |
| PubChem | 3301 | |
| UNII | 60V9STC53F | |
| KEGG | D01114 | |
| Propiedades físicas | ||
| Densidad | 899,5 kg/m³; 0,8995 g/cm³ | |
| Masa molar | 60,069 g/mol | |
| Punto de fusión | 8 °C (281 K) | |
| Punto de ebullición | 116,5 °C (390 K) | |
| Índice de refracción (nD) | 1,4565 | |
| Propiedades químicas | ||
| Acidez | 9,98 pKa | |
| Riesgos | ||
| LD50 | 500 mg/kg (oral, ratas) | |
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. | ||
Aplicaciones
La etilendiamina se utiliza como ligando quelante y en la síntesis de la EDTA. Es un ligando bidentado que utiliza el par de electrones que hay sobre cada Nitrógeno para quelar cationes metálicos.
Toxicología
La etilendiamina es irritante en contacto con la piel, al inhalar los vapores o en contacto con ojos y las mucosidades. Al ingerirlo daña riñones e hígado.
Este artículo ha sido escrito por Wikipedia. El texto está disponible bajo la licencia Creative Commons - Atribución - CompartirIgual. Pueden aplicarse cláusulas adicionales a los archivos multimedia.