Ferricianuro
El ferricianuro es un anión de fórmula empírica C
6N
6Fe3−
y fórmula semidesarrollada [Fe(CN)
6]3−
también llamado hexacianoferrato(III) y en forma más rara, aunque la correcta desde el punto de vista sistemático, hexacianuroferrato(III).
| Ferricianuro | ||
|---|---|---|
 | ||
 | ||
| Nombre IUPAC | ||
| Hexacianuro de hierro (3+) | ||
| General | ||
| Otros nombres | Hexacianuroferrato(III), Hexacianuro férrico; hexacianoferrato (3-). | |
| Fórmula molecular |
C 6N 6Fe3− | |
| Identificadores | ||
| Número CAS | 13408-62-3[1] | |
| ChEBI | 5020 | |
| PubChem | 439210 | |
| KEGG | C00324 | |
|
[C-]#N.[C-]#N.[C-]#N.[C-]#N.[C-]#N.[C-]#N.[Fe+3]
| ||
| Propiedades físicas | ||
| Masa molar | 2 119 494 g/mol | |
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. | ||
La sal más común de este anión es el ferricianuro de potasio, un material cristalino de color rojo que se utiliza como agente oxidante en química orgánica.[2]
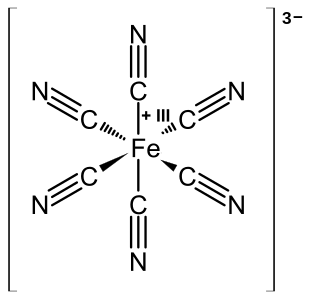
Propiedades
El anión [Fe(CN)
6]3−
es un anión complejo consistente en un centro de Fe3+
rodeado por seis ligandos cianuros en un arreglo octaédrico. El complejo posee una simetría Oh. El hierro se encuentra en una configuración de bajo espín, y puede ser reducido fácilmente al anión emparentado ferrocianuro [Fe(CN)
6]4−
, el cual es un derivado ferroso (Fe2+
).
Esta pareja redox es reversible, y no implica la formación o ruptura de enlaces Fe-C:
6]3−
+ e−
→ [Fe(CN)
6]4−
Esta pareja redox es un estándar en electroquímica.
Comparado con otros cianuros más comunes tales como el cianuro de potasio, el ferricianuro es mucho menos tóxico debido al fuerte enlace entre el CN−
y el Fe3+
. Sin embargo puede reaccionar con ácidos minerales fuertes para liberar el gas altamente tóxico cianuro de hidrógeno.
Usos
El tratamiento del ferricianuro con sales ferrosas, produce el duradero y brillante pigmento de color azul conocido como azul de Prusia, el color tradicional de los antiguos planos azules.
Referencias
- Número CAS
- Gail, E.; Gos, S.; Kulzer, R.; Lorösch, J.; Rubo, A.; Sauer, M.; Kellens, R.; Reddy, J.; Steier, N.; Hasenpusch, W. (16 de octubre de 2011). «Cyano Compounds, Inorganic». Ullmann's Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. doi:10.1002/14356007.a08_159.pub3.