Forbol
Forbol con fórmula química C20H28O6 es un compuesto orgánico natural derivado de planta. Es un miembro de la familia tigliane de diterpenos. Forbol se aisló por primera vez en 1934 como la hidrólisis del producto de aceite de crotón, que se deriva de las semillas de Croton tiglium.[2][3][4][5][6] La estructura de forbol se determinó en 1967.[7][8] Es muy soluble en la mayoría de las polaridades de los disolventes orgánicos, así como en agua.
| Forbol | ||
|---|---|---|
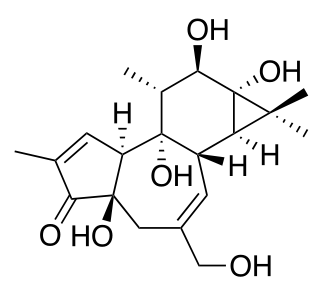 | ||
| Nombre IUPAC | ||
| 1,1a,1b,4,4a,7a,7b,8,9,9a-decahydro-4a,7b,9,9a-tetrahydroxy-3-(hydroxymethyl)-1,1,6,8-tetramethyl-5H-cyclopropa[3,4]benz[1,2-e]azulen-5-one | ||
| General | ||
| Fórmula estructural |
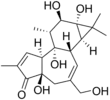 | |
| Fórmula molecular | ? | |
| Identificadores | ||
| Número CAS | 17673-25-5[1] | |
| ChEBI | 8116 | |
| ChEMBL | CHEMBL124518 | |
| ChemSpider | 390610 | |
| PubChem | 442070 | |
| UNII | XUZ76S9127 | |
| KEGG | C09155 | |
|
OCC1=C[C@]([C@@](C(C)4C)([H])[C@]4(O)[C@H](O)[C@H]2C)([H])[C@]2(O)[C@@](C=C(C)C3=O)([H])[C@@]3(O)C1
| ||
| Propiedades físicas | ||
| Masa molar | 364.44 g/mol g/mol | |
| Índice de refracción (nD) | 1,648 | |
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. | ||
Varios ésteres de forbol tienen importantes propiedades biológicas, la más notable de las cuales es la capacidad para actuar como promotores tumorales a través de la activación de la proteína quinasa C.[9] Ellos imitan los diacilgliceroles , derivados de glicerol en el que dos grupos hidroxilo han reaccionado con ácidos grasos para formar ésteres. El éster de forbol más común es 12 - O -tetradecanoilforbol-13-acetato (TPA), también llamado de forbol-12-miristato-13-acetato (PMA), que se utiliza como una herramienta de investigación biomédica en modelos de carcinogénesis . TPA, junto con ionomicina, puede también ser utilizado para estimular la activación de células T, la proliferación, y la producción de citoquinas, y se usa en los protocolos para la tinción intracelular de estas citoquinas.[10]
Referencias
- Número CAS
- Flaschenträger B, v. Wolffersdorff R (1934). «Über den Giftstoff des Crotonöles. 1. Die Säuren des Crotonöles». Helvetica Chimica Acta 17 (1): 1444-1452. doi:10.1002/hlca.193401701179.
- Flaschenträger B, Wigner G (1942). «Über den Giftstoff des Crotonöles. V. Die Gewinnung von Crotonharz, Dünnem Öl und Phorbol aus dem Crotonöl durch Alkoholyse». Helvetica Chimica Acta 25 (3): 569-581. doi:10.1002/hlca.19420250315.
- Kauffmann T, Neumann H, Lenhardt K (1959). «Zur Konstitution des Phorbols, I. Über die reduzierende Gruppe des Phorbols». Chemische Berichte 92 (8): 1715-1726. doi:10.1002/cber.19590920802.
- Kauffmann T, Eisinger A, Jasching W, Lenhardt K (1959). «Zur Konstitution des Phorbols, I. Über die reduzierende Gruppe des Phorbols». Chemische Berichte 92 (8): 1727-1738. doi:10.1002/cber.19590920803.
- Tseng S-S, van Duuren BL, Solomon JJ (1977). «Synthesis of 4aα-Phorbol 9-Myristate 9a-Acetate and Related Esters». J. Org. Chem. 42 (33): 3645-3649. doi:10.1021/jo00443a002.
- Hecker E, Bartsch H, Bresch H, Gschwendt M, Härle B, Kreibich G, Kubinyi H, Schairer HU, v. Szczepanski C, Thielmann HW (1967). «Structure and Stereochemistry of the Tetracyclic Diterpene Phorbol from Croton tiglium L». Tetrahedron Letters 8 (33): 3165-3170. doi:10.1016/S0040-4039(01)89890-7.
- Pettersen RC, Ferguson G, Crombie L, Games ML, Pointer DJ (1967). «The Structure and Stereochemistry of Phorbol, Diterpene Parent of Co-carcinogens of Croton Oil». Chem. Commun. (London) 1967 (14): 716-717. doi:10.1039/C19670000716.
- Blumberg PM (1988). «Protein Kinase C as the Receptor for the Phorbol Ester Tumor Promoters: Sixth Rhoads Memorial Award Lecture» (pdf). Cancer Res. 48 (1): 1-8. PMID 3275491.
- «Flow Cytometry Intracellular Staining Guide». eBioscience, Inc. Consultado el 25 de septiembre de 2011.
Enlaces externos
- MeSH: Phorbols (en inglés)
- Esta obra contiene una traducción derivada de «Phorbol» de Wikipedia en inglés, publicada por sus editores bajo la Licencia de documentación libre de GNU y la Licencia Creative Commons Atribución-CompartirIgual 4.0 Internacional.
 Wikimedia Commons alberga una categoría multimedia sobre Forbol.
Wikimedia Commons alberga una categoría multimedia sobre Forbol.