Fosforilasa cinasa
La fosforilasa cinasa (PHK) (EC 2.7.11.19) es una serina/treonina proteína cinasa específica que activa la glucógeno fosforilasa para liberar glucosa-1-fosfato procedente del glucógeno. La PHK fosforila la glucógeno fosforilasa en dos residuos serina provocando un cambio conformacional que favorece a la glucógeno fosforilasa "a" más activa que la glucógeno fosforilasa "b" desfosforilada.[3][4]
- Glucógeno fosforilasa b + 2 ATP Glucógeno fosforilasa a + 2 ADP
| Fosforilasa cinasa subunidad catalítica gamma 1[1] | ||||
|---|---|---|---|---|
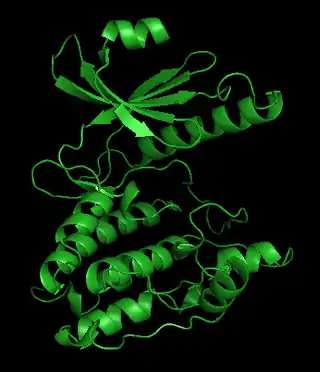 Figura 1. Estructura de la subunidad catalítca gamma | ||||
| Estructuras disponibles | ||||
| PDB | ||||
| Identificadores | ||||
| Símbolos | PHKG1 (HGNC: 8930) PHKG | |||
| Identificadores externos |
Bases de datos de enzimas
| |||
| Número EC | 2.7.11.19 | |||
| Locus | Cr. 7 p11.2 | |||
| Estructura/Función proteica | ||||
| Tamaño | 387 (aminoácidos) | |||
| Ortólogos | ||||
| Especies |
| |||
| Entrez |
| |||
| UniProt |
| |||
| RefSeq (ARNm) |
| |||
| PubMed (Búsqueda) |
| |||
| PMC (Búsqueda) |
| |||
| Fosforilasa cinasa subunidad catalítica gamma 2[2] | ||||
|---|---|---|---|---|
| Estructuras disponibles | ||||
| PDB | ||||
| Identificadores | ||||
| Símbolos | PHKG2 (HGNC: 8930) PHK-gamma-T | |||
| Identificadores externos |
Bases de datos de enzimas
| |||
| Número EC | 2.7.11.19 | |||
| Locus | Cr. 16 p11.2 | |||
| Estructura/Función proteica | ||||
| Tamaño | 406 (aminoácidos) | |||
| Ortólogos | ||||
| Especies |
| |||
| Entrez |
| |||
| UniProt |
| |||
| RefSeq (ARNm) |
| |||
| PubMed (Búsqueda) |
| |||
| PMC (Búsqueda) |
| |||
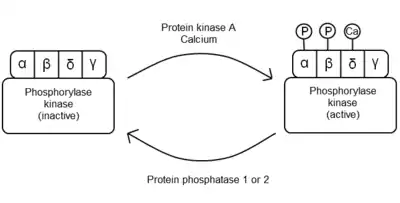
La enzima se presenta como un homotetrámero de tetrámeros situados en forma de "mariposa". Cada uno de los cuatro tetrámeros está formado de una subunidad α, una subunidad β, una subunidad γ y una subunidad δ. La subunidad γ contiene el sitio con actividad catalítica mientras que las otras tres subunidades tienen funciones reguladoras.
Cuando no están modificadas las subunidades α y β inhiben la catálisis enzimática, pero la fosforilación de ambas unidades por la proteína cinasa A reduce sus actividades inhibidoras. La subunidad δ es la proteína eucariota calmodulina que tiene 4 sitios de unión para el ion calcio. Cuando los niveles citosólicos de Ca2+ suben por encima de ≈10-7 M, la subunidad δ sufre un gran cambio conformacional que activa la actividad cinasa uniéndose a la subunidad γ catalítica.[5]
Genes
Los genes relacionados con la fosforilasa cinasa son:
- Subunidad alfa: PHKA1, PHKA2
- Subunidad beta: PHKB
- Subunidad catalítica gamma: PHKG1, PHKG2
- Subunidad delta (calmodulina): CALM1, CALM2, CALM3
Las fichas proteína de esta página representan las subunidades gamma catalíticas.
Historia
La fosforilasa cinasa fue la primera proteína cinasa en ser aislada y caracterizada en detalle. Lo consiguieron por primera vez Krebs, Graves y Fischer en los años 1950.[6][7][8] En ese momento, la comunidad científica no era consciente de la importancia de la fosforilación de proteínas en la regulación de los procesos celulares y muchos consideraban a las fosfoproteínas como no importantes biológicamente. Como la modificación covalente por fosforilación es un método extendido e importante para la regulación bioquímica en una gran variedad de procesos celulares, el descubrimiento de la fosforilasa cinasa tuvo un enorme impacto en el conocimiento científico de los mecanismos reguladores.
El sustrato de la PHK, la glucógeno fosforilasa, fue aislada por Carl and Gerty Cori en los años 1930. Determinaron que existían dos formas: una forma inactiva "b" y una forma activa "a". Por razones desconocidas en aquel momento, la única forma de aislar la glucógeno fosforilasa "a" del tejido muscular era mediante filtración por papel - otros métodos como la centrifugación no funcionaban. Fue Fischer et al. quien teorizó que la presencia de iones calcio en el papel de filtro era la que generaba la forma "a" activa. Investigaciones posteriores revelaron que los iones calcio estaban activando la fosforilasa cinasa a través de la subunidad reguladora δ provocando la fosforilación de la glucógeno fosforilasa.[9][10][11]
Mecanismo
Los detalles precisos del mecanismo catalítico de la fosforilasa cinasa todavía están en estudio.[12][13][14][15][16] Aunque parezca sorprendente ya que la enzima fue aislada hace unos 50 años, existen dificultades significativas en estudiar los detalles finos de la estructura y mecanismo de la PHK debido a su tamaño grande y a su alto nivel de complejidad.[5] En el sitio activo, existe una homología significativa entre la PHK y otras proteínas cinasas como la proteína cinasa A. En contraste a estas proteínas que típicamente requieren la fosforilación de un residuo serina o treonina en el sitio catalítico para ser activas, la subunidad catalítica γ de la PHK está constituvimante activa debido a la presencia de un residuo glutamato (Glu-182) cargado negativamente.[14][15]
Datos estructurales y bioquímicos sugieren un posible mecanismo de acción para la fosforilación de la glucógeno fosforilasa por la PHK: La transferencia directa del grupo fosfato desde el ATP al sustrato serina.[12]
Estructura
La fosforilasa cinasa es una holoenzima hexadecamérica de peso molecular 1.3 MDa, aunque su tamaño puede variar algo debido a las diferentes isoformas de las subunidades obtenidas por splicing de mRNA.[17][18][19] Consiste en cuatro homotetrámeros cada uno formado de cuatro subunidades (α,β,δ,γ). Solamente la subunidad γ tiene actividad catalítica, mientras que las otras tienen funciones reguladoras. Debido a la inestabilidad de las subunidades reguladoras en solución, solamente la subunidad γ se ha cristalizado individualmente.
Las subunidades están situadas en dos lóbulos orientados espalda contra espalda en lo que se ha descrito como una forma de "mariposa" con simetría D2.[17][20][21] Cada lóbulo consiste de dos tetrámeros, cada uno formado por las subunidades αβδγ mencionadas anteriormente. La subunidad δ es la calmodulina, mientras que las subunidades α y β son homólogos estrechamente relacionados uno con el otro y se ha propuesto que se han formado por duplicación del gen y la consiguiente diferenciación.[22]
Función biológica y regulación
Fisiológicamente la fosforilasa cinasa juega un papel importante en estimular la degradación del glucógeno a glucosa libre mediante la fosforilación de la glucógeno fosforilasa y estabilizando su forma activa. Esta actividad es particularmente importante en las células del hígado y del músculo, aunque para propósitos diferentes. Mientras que en las células musculares la degradación del glucógeno sirve para proporcionar la energía para la actividad física que se está llevando a cabo, en las células del hígado la degradación del glucógeno es responsable de mantener la concentración de glucosa en la sangre. Por tanto, los mecanismos reguladores de la actividad de la PHK varían algo dependiendo del tipo de célula.[3]
En general, la enzima está regulada alostéricamente y por fosforilación reversible. Las hormonas, los impulsos nerviosos y la contracción del músculo estimulan la liberación de iones calcio. Estos actúan como activadores alostéricos, uniéndose a las subunidades δ de la fosforilasa cinasa y activando parcialmente la actividad enzimática. Esta unión estabiliza parcialmente la proteína en la forma activa. La fosforilasa cinasa está completamente activada cuando las subunidades α y β son fosforiladas por la proteína cinasa A y la subunidad δ está unida a iones calcio.[5][10][23]
En las células musculares, la fosforilación de las subunidades α y β por la proteína cinasa A es el resultado de una cascada de señalización mediada por AMPc iniciada por la unión de la epinefrina a los receptores beta-adrenérgicos de la superficie celular. Adicionalmente, la liberación de iones calcio del retículo sarcoplasmático durante la contracción muscular inactiva la subunidad δ inhibidora y activa totalmente la PHK.
En las células del hígado, el proceso es algo más complejo. El glucagón y la epinefrina pueden empezar la cascada cAMP-proteína cinasa A, pero la epinefrina también se puede unir a un receptor alfa-adrenérgico para empezar una cascada fosfoinositida resultando en la liberación de Ca2+ del retículo endoplasmático.
Cuando la célula necesita parar la degradación de glucógeno, la PHK es defosforilada por las fosfatasas 1 y 2, devolviendo a las subunidades α y β a su configuración inhibidora inicial.[24][25]
Relevancia clínica
Los defectos en los genes de la fosforilasa cinasa pueden resultar en síntomas fisiológicos clasificados como enfermedades de almacenamiento de glucógeno. Entre éstas, algunas de las más comunes son las glucogenosis del hígado (XLG), que pueden ser subdivididas en XLG I y XLG II.[26][27] Clínicamente, estas enfermedades se manifiestan por un desarrollo físico lento durante la niñez y por un tamaño anormalmente grande del hígado. En la XLG I la actividad de la PHK está anormalmente reducida en las células hepáticas y en las de la sangre, mientras que en la XLG II la actividad enzimática está disminuida solamente en las células hepáticas. Estas dos enfermedades están debidas a mutaciones en el gen PHKA2, que codifica la subunidad α de la fosforilasa cinasa. En el caso de la XLG I, las mutaciones resultan en subunidades α malformadas e inestables, mientras que en la XLG II las mutaciones alteran las subunidades menos severamente. Basados en datos estructurales y bioinformáticos, algunos han sugerido que las subunidades α y β pueden tener una actividad catalítica similar a las glicoamilasas y que las mutaciones en la subunidad α pueden contribuir a los síntomas de la XLG II.[28][29] De todas formas, esta actividad catalítica no ha sido aun confirmada.
Referencias
- «PHKG1 Gene». Consultado el 23 de octubre de 2011.
- «PHKG2 Gene». Consultado el 23 de octubre de 2011.
- Berg, J., Tymoczko, J. & Stryer, L. Biochemistry. W.H. Freeman and Co.: New York, 2007.
- «ENZYME entry: EC 2.7.11.19». Consultado el 23 de octubre de 2011.
- Brushia R, Walsh D (1999). «Phosphorylase kinase: the complexity of its regulation is reflected in the complexity of its structure». Front Biosci 4: D618-41. PMID 10487978. doi:10.2741/Brushia.
- Fischer EH (2010). «Phosphorylase and the origin of reversible protein phosphorylation». Biol Chem 391 (2–3): 131-137. PMID 20030590. doi:10.1515/BC.2010.011.
- Krebs EG, Graves DJ, Fischer EH (1959). «Factors affecting the activity of muscle phosphorylase b kinase». J Biol Chem 234: 2867-2873. PMID 14411853.
- Fischer EH, Krebs EG (1955). «Conversion of phosphorylase b to phosphorylase a in muscle extracts». J Biol Chem 216 (1): 121-132. PMID 13252012.
- Cohen P, Burchell A, Foulkes JG, Cohen PT (1978). «Identification of the Ca2+-dependent modulator protein as the fourth subunit of rabbit skeletal muscle phosphorylase kinase». FEBS Lett 92 (2): 287-293. PMID 212300. doi:10.1016/0014-5793(78)80772-8.
- Cohen P (1982). «The role of protein phosphorylation in neural and hormonal control of cellular activity». Nature 296 (5858): 613-620. PMID 6280056. doi:10.1038/296613a0.
- Cohen P (1973). «The Subunit Structure of Rabbit-Skeletal-Muscle Phosphorylase Kinase, and the Molecular Basis of Its Activation Reactions». Eur J Biochem 34 (1): 1-14. PMID 4349654. doi:10.1111/j.1432-1033.1973.tb02721.x.
- Skamnaki VT et al. (1999). «Catalytic mechanism of phosphorylase kinase probed by mutational studies». Biochemistry 38 (44): 14718-14730. PMID 10545198. doi:10.1021/bi991454f.
- Graves D, Bartleson C, Biorn A, Pete M (1999). «Substrate and inhibitor recognition of protein kinases: what is known about the catalytic subunit of phosphorylase kinase?». Pharmacol Ther 82 (2–3): 143-155. PMID 10454193. doi:10.1016/S0163-7258(98)00049-7.
- Lowe ED et al. (1997). «The crystal structure of a phosphorylase kinase peptide substrate complex: kinase substrate recognition». EMBO J 16 (22): 6646-6658. PMC 1170269. PMID 9362479. doi:10.1093/emboj/16.22.6646.
- Owen DJ, Noble ME, Garman EF, Papageorgiou AC, Johnson LN (1995). «Two structures of the catalytic domain of phosphorylase kinase: an active protein kinase complexed with substrate analogue and product». Structure 3 (5): 467-482. PMID 7663944. doi:10.1016/S0969-2126(01)00180-0.
- Johnson LN (2009). «The regulation of protein phosphorylation». Biochem Soc Trans 37 (Pt 4): 627-641. PMID 19614568. doi:10.1042/BST0370627.
- Vénien-Bryan C et al. (2009). «The Structure of Phosphorylase Kinase Holoenzyme at 9.9 Å Resolution and Location of the Catalytic Subunit and the Substrate Glycogen Phosphorylase». Structure 17 (1): 117-127. PMC 2639635. PMID 19141288. doi:10.1016/j.str.2008.10.013.
- Wüllrich A, Hamacher C, Schneider A, Kilimann MW (1993). «The multiphosphorylation domain of the phosphorylase kinase alpha M and alpha L subunits is a hotspot of differential mRNA processing and of molecular evolution». J Biol Chem 268 (31): 23208-23214. PMID 8226841.
- Kilimann MW (1990). «Molecular genetics of phosphorylase kinase: cDNA cloning, chromosomal mapping and isoform structure». J Inherit Metab Dis 13 (4): 435-441. PMID 2122110. doi:10.1007/BF01799500.
- Nadeau OW, Gogol EP, Carlson GM (2005). «Cryoelectron microscopy reveals new features in the three-dimensional structure of phosphorylase kinase». Protein Sci 14 (4): 914-920. PMC 2253458. PMID 15741332. doi:10.1110/ps.041123905.
- Vénien-Bryan C et al. (2002). «Three-dimensional structure of phosphorylase kinase at 22 A resolution and its complex with glycogen phosphorylase b». Structure 10 (1): 33-41. PMID 11796108. doi:10.1016/S0969-2126(01)00691-8.
- Kilimann MW et al. (1988). «The alpha and beta subunits of phosphorylase kinase are homologous: cDNA cloning and primary structure of the beta subunit». Proc Natl Acad Sci USA 85 (24): 9381-9385. PMC 282756. PMID 3200826. doi:10.1073/pnas.85.24.9381.
- Heilmeyer LM (1991). «Molecular basis of signal integration in phosphorylase kinase». Biochim Biophys Acta 1094 (2): 168-174. PMID 1892899. doi:10.1016/0167-4889(91)90005-I.
- Ingebritsen TS, Foulkes JG, Cohen P (1983). «The protein phosphatases involved in cellular regulation. 2. Glycogen metabolism». Eur J Biochem 132 (2): 263-274. PMID 6301825. doi:10.1111/j.1432-1033.1983.tb07358.x.
- Ingebritsen TS, Stewart AA, Cohen P (1983). «The protein phosphatases involved in cellular regulation. 6. Measurement of type-1 and type-2 protein phosphatases in extracts of mammalian tissues; an assessment of their physiological roles». Eur J Biochem 132 (2): 297-307. PMID 6301829. doi:10.1111/j.1432-1033.1983.tb07362.x.
- Hendrickx J, Willems PJ (1996). «Genetic deficiencies of the glycogen phosphorylase system». Hum Genet 97 (5): 551-556. PMID 8655128. doi:10.1007/BF02281858.
- Hendrickx J et al. (1999). «Complete genomic structure and mutational spectrum of PHKA2 in patients with x-linked liver glycogenosis type I and II». Am J Hum Genet 64 (6): 1541-1549. PMC 1377897. PMID 10330341. doi:10.1086/302399.
- Pallen MJ (2003). «Glucoamylase-like domains in the α- and β-subunits of phosphorylase kinase». Protein Sci 12 (8): 1804-1807. PMC 2323967. PMID 12876330. doi:10.1110/ps.0371103.
- Carrière C, Jonic S, Mornon J, Callebaut I (2008). «3D mapping of glycogenosis-causing mutations in the large regulatory alpha subunit of phosphorylase kinase». Biochim Biophys Acta 1782 (11): 664-670. PMID 18950708. doi:10.1016/j.bbadis.2008.09.011.