Gamma-glutamil carboxilasa
La gamma-glutamil carboxilasa es una enzima que en los humanos se encuentra codificada por el gen GGCX, localizado en el brazo corto del cromosoma 2 (2p12), este gen abarca 13 Kpb y consta de 15 exones que codifican para una proteína de 758 aminoácidos. La proteína gamma-glutamil carboxilasa es una proteína integral de membrana, asociada con la membrana del retículo endoplasmático y consta de tres dominios transmembrana[1]
| Gamma-glutamil carboxilasa | |||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Estructuras disponibles | |||||||||||||||
| PDB | |||||||||||||||
| Identificadores | |||||||||||||||
| Símbolos | GGCX (HGNC: 4247) ; VKCFD1 | ||||||||||||||
| Identificadores externos |
Bases de datos de enzimas
| ||||||||||||||
| Número EC | 4.1.1.90 | ||||||||||||||
| |||||||||||||||
| Patrón de expresión de ARNm | |||||||||||||||
 | |||||||||||||||
 | |||||||||||||||
| Más información | |||||||||||||||
| Ortólogos | |||||||||||||||
| Especies |
| ||||||||||||||
| Entrez |
| ||||||||||||||
| Ensembl |
| ||||||||||||||
| UniProt |
| ||||||||||||||
| RefSeq (ARNm) |
| ||||||||||||||
| RefSeq (proteína) NCBI |
| ||||||||||||||
| Ubicación (UCSC) |
| ||||||||||||||
| PubMed (Búsqueda) |
| ||||||||||||||
Función
La gamma-glutamil carboxilasa es una enzima que cataliza la modificación postraduccional de las proteínas dependientes de vitamina K. El resultado de esta modificación es la formación de un residuo gamma-carboxiglutamato sobre el extremo de un glutamato, a este residuo se lo denomina gla. Muchas de las proteínas dependientes de vitamina K se encuentran involucradas en la coagulación, de forma que la función de esta enzima es fundamental para la hemostasia.[2] La mayor parte de las proteínas que contienen el dominio gla dependen de esta reacción de carboxilación para su modificación postraduccional.[3] En humanos, la enzima gamma-glutamil carboxilasa se expresa mayoritariamente en el hígado.
Reacción catalítica
La enzima gamma-glutamil carboxilasa oxida a la vitamina K hidroquinona (KH
2) a vitamina K 2,3 epóxido (KO), mientras que simultáneamente añade un CO
2 al residuo terminal de un ácido glutámico (Glu) que forma parte de la proteína, para formar ácido gamma-carboxiglutámico (también llamado gamma-carboxiglutamato - Gla).
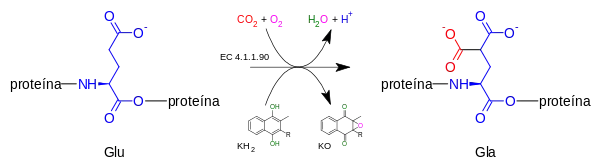
2) + CO
2 + oxígeno → una [proteína] 4-carboxi-L-glutamato (Gla) + vitamina K 2,3-epóxido (KO) + H+
+ H
2O
Esta reacción de carboxilación únicamente puede proceder si la carboxilasa es capaz de oxidar a la vitamina K hidroquinona (KH
2) para formar vitamina K epóxido (KO), por lo que se dice que ambas reacciones se encuentran acopladas.[4][5][6]
En el organismo, la KO se recicla a VKH
2 por medio de la enzima vitamina K epóxido reductasa.
Importancia clínica
Las mutaciones en este gen se encuentran asociadas con defectos de la coagulación dependientes de vitamina K, y con el desorden similar a pseudoxantoma elástico que se presenta con múltiples deficiencias en los factores de coagulación.[2][7]
Véase también
- Carboxiglutamato
Referencias
- Wu SM, Cheung WF, Frazier D, Stafford DW (diciembre de 1991). «Cloning and expression of the cDNA for human gamma-glutamyl carboxylase». Science 254 (5038): 1634-6. PMID 1749935. doi:10.1126/science.1749935.
- «Entrez Gene: GGCX».
- Brenner B, Tavori S, Zivelin A, Keller CB, Suttie JW, Tatarsky I, Seligsohn U (agosto de 1990). «Hereditary deficiency of all vitamin K-dependent procoagulants and anticoagulants». Br. J. Haematol. 75 (4): 537-42. PMID 2145029. doi:10.1111/j.1365-2141.1990.tb07795.x.
- Suttie JW (1985). «Vitamin K-dependent carboxylase». Annu. Rev. Biochem. 54 (1): 459-77. PMID 3896125. doi:10.1146/annurev.bi.54.070185.002331.
- Presnell SR, Stafford DW (2002). «The vitamin K-dependent carboxylase». Thromb. Haemost. 87 (6): 937-46. PMID 12083499.
- Silva PJ, Ramos MJ (2007). «Reaction mechanism of the vitamin K-dependent glutamate carboxylase: a computational study». J Phys Chem B 111 (44): 12883-7. PMID 17935315. doi:10.1021/jp0738208.
- Vanakker OM, Martin L, Gheduzzi D, Leroy BP, Loeys BL, Guerci VI, Matthys D, Terry SF, Coucke PJ, Pasquali-Ronchetti I, De Paepe A (marzo de 2007). «Pseudoxanthoma elasticum-like phenotype with cutis laxa and multiple coagulation factor deficiency represents a separate genetic entity». J. Invest. Dermatol. 127 (3): 581-7. PMID 17110937. doi:10.1038/sj.jid.5700610.
Lecturas adicionales
- Bandyopadhyay PK (2008). «Vitamin K-dependent gamma-glutamylcarboxylation: an ancient posttranslational modification». Vitam. Horm. 78: 157-84. PMID 18374194. doi:10.1016/S0083-6729(07)00008-8.
- Berkner KL (2008). «Vitamin K-dependent carboxylation». Vitam. Horm. 78: 131-56. PMID 18374193. doi:10.1016/S0083-6729(07)00007-6.
- Oldenburg J, Marinova M, Müller-Reible C, Watzka M (2008). «The vitamin K cycle». Vitam. Horm. 78: 35-62. PMID 18374189. doi:10.1016/S0083-6729(07)00003-9.
- Berkner KL (2005). «The vitamin K-dependent carboxylase». Annu. Rev. Nutr. 25 (1): 127-49. PMID 16011462. doi:10.1146/annurev.nutr.25.050304.092713.
- Zhang B, Ginsburg D (septiembre de 2004). «Familial multiple coagulation factor deficiencies: new biologic insight from rare genetic bleeding disorders». J. Thromb. Haemost. 2 (9): 1564-72. PMID 15333032. doi:10.1111/j.1538-7836.2004.00857.x.
- Wallin R, Hutson SM (julio de 2004). «Warfarin and the vitamin K-dependent gamma-carboxylation system». Trends Mol Med 10 (7): 299-302. PMID 15242675. doi:10.1016/j.molmed.2004.05.003.
- Berkner KL (agosto de 2000). «The vitamin K-dependent carboxylase». J. Nutr. 130 (8): 1877-80. PMID 10917896.
- Presnell SR, Stafford DW (junio de 2002). «The vitamin K-dependent carboxylase». Thromb. Haemost. 87 (6): 937-46. PMID 12083499.
- Bender, David A. (2003). Nutritional biochemistry of the vitamins. Cambridge, UK: Cambridge University Press. ISBN 0-521-80388-8.
- Ball, George E. (2004). Vitamins: their role in the human body. Oxford: Blackwell Science. ISBN 0-632-06478-1.
- Combs, Gerald F. (1998). The vitamins: fundamental aspects in nutrition and health. Boston: Academic Press. ISBN 0-12-183492-1.
Enlaces externos s
- MeSH: glutamyl+carboxylase (en inglés)