Glucósido cianogénico
Los glucósidos cianogénicos son toxinas vegetales derivadas de aminoácidos producidas como metabolitos secundarios de las plantas con función de defensa. La mayoría de las plantas que los contienen al ser consumidas por humanos se hidrolizan, y al liberar dichos glucósidos cianogénicos liberan a su vez cianuro de hidrógeno (Hegnauer 1977[1]), también llamado ácido cianhídrico (HCN), el cual produce daño tisular y es uno de los venenos más potentes y de acción más rápida conocidos. Este proceso se denomina cianogénesis.[2]
Estructura química
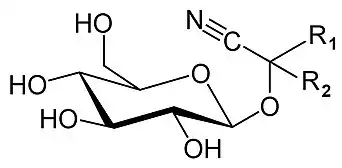
Están formados por una aglicona, un azúcar y una molécula de ácido cianhídrico.[3] Poseen un grupo nitrilo unido a un carbono, el cual está unido mediante un enlace glucosídico a un azúcar y a otros dos grupos distintos.[4]
Son compuestos muy dispares estructuralmente hablando, pero se cree que casi todos derivan de seis aminoácidos (L-valina, L-isoleucina, L-leucina, L-fenilalanina, L-tirosina, ciclopentenilglicina).[2]
Historia
La primera vez que se aislaron los glucósidos cianogénicos fue del hueso de los albaricoques, más tarde se descubrió que también se encontraban en los huesos y en las semillas de melocotones, nectarinas, manzanas, cerezas y almendras.[5]
Glucósidos cianogénicos en la naturaleza
Se conocen alrededor de 25 glucósidos cianogénicos, algunos de los cuales parecen haberse originado muchas veces evolutivamente, mientras que otros parecen haber aparecido una sola vez y ienen, por lo tanto, una distribución restringida a solo algunos taxones emparentados de plantas.
Se pueden encontrar en especies de plantas como fabáceas o leguminosas, rosáceas glucósidos cianogénicos derivados de aminoácidos ramificados, o de otros aminoácidos en lináceas y compuestas.
Se localizan en las partes comestibles de las plantas (manzanas, albaricoques, cerezas, melocotones, ciruelas, membrillos, especialmente en la semilla de los mismos), e incluso en almendras, fruta de hueso, fruta de pepita, mandioca, brotes de bambú, linaza, lima, frijoles, coco yam, garbanzos, anacardos y kirsch. También se encuentran en algunos ingredientes alimentarios con propiedades aromatizantes, como almendras molidas, mazapán, fruta de hueso y bebidas alcohólicas hechas a base de frutas de hueso.[2]
Biosíntesis
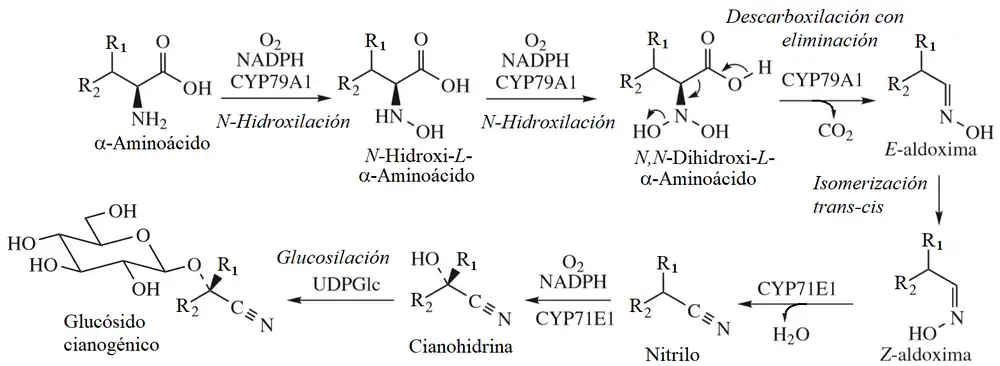
Los glucósidos cianogénicos se producen a partir de una variedad de aminoácidos mediante una vía común. El aminoácido primero se hidroxila en el nitrógeno (N-hidroxilada) y luego convertida en la oxima aldehído (aldoxima) por una secuencia que implica dos N-hidroxilaciones y posterior descarboxilación - eliminación, con todas estas reacciones catalizadas por una sola enzima dependiente del citocromo P-450. El nitrilo se forma por la deshidratación de la oxima, pero esta reacción en realidad continúa en la Z-aldoxima producida por la isomerización de la primera E-aldoxima formada. La cianohidrina es el resultado de una reacción de hidroxilación estereoselectiva dependiente del citocromo P-450. Finalmente, ocurre la glicosilación, la unidad de azúcar generalmente es glucosa. La estereoselectividad de la etapa de hidroxilación de nitrilo varía según el sistema de la planta, por lo que las cianohidrinas epiméricas se encuentran en la naturaleza, aunque no en la misma planta.[6]
Toxicidad
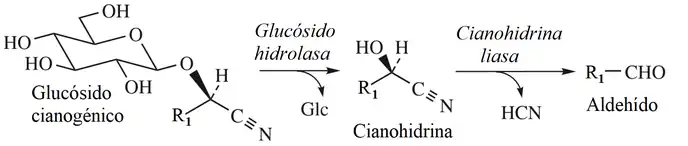
No son tóxicos por sí solos, sino que su toxicidad depende de la liberación de cianuro de hidrógeno que, a su vez, depende de la capacidad de los glucósidos cianogénicos de hidrolizarse espontáneamente o en presencia de enzimas como la β-glucosidasa que formará azúcares y cianhidrina, la cual sufre descomposición espontánea a ácido cianhídrico (HCN, sustancia volátil) y una cetona o aldehído. Además, esta hidrólisis puede producirse cuando las plantas que los contienen son masticadas por herbívoros o cuando se desintegran durante el procesado (al molerlas, al ser golpeadas, presencia de agua al remojarlas o fermentarlas).
Los niveles tóxicos de glucósidos cianogénicos son estimados en función de la cantidad de cianuro libre, considerando 0,5-3,5 mg de HCN/kg de peso corporal como dosis tóxica. Pero la carencia de pruebas toxicológicas y la dificultad de la estimación de los glucósidos cianogénicos de la dieta, complica el establecimiento de niveles seguros de ingesta de toma de estos compuestos.
Hay casos tanto de intoxicación aguda, donde la exposición es intencional y accidental, como de intoxicación crónica pudiendo verse implicado en afectación neurológica irreversible a largo plazo.
Por un lado, el envenenamiento por cianuro tiene lugar cuando el HCN se une a metaloproteínas como citocromo c oxidasa, enzima terminal y clave de la cadena respiratoria, inhibiéndola y deteniendo así el transporte de electrones y la fosforilación oxidativa, necesaria para la síntesis de ATP y para continuar la respiración celular. Los síntomas producidos son vómitos, diarrea, dolor de estómago, debilidad, convulsiones e incluso la muerte en cuadros graves.
Por el otro, la intoxicación crónica debida a una ingesta abundante y sostenida de estos compuestos o a una exposición laboral puede causar Konzo, que es una enfermedad neurológica irreversible, así como neuropatía atáxica tropical, bocio y cretinismo y retraso en el crecimiento.
La gravedad de la intoxicación dependerá de la edad, ya que, por ejemplo, los niños por su tamaño corporal más pequeño serán especialmente susceptibles de sufrir intoxicación, además de la variedad a la que pertenezca la planta consumida y de factores ambientales. Los herbívoros se llegan a adaptar a comer plantas cianogénicas y toleran altas cantidades de HCN.[2][7]
Detoxificación
El cianuro es detoxificado en el cuerpo por las enzimas sulfotransferasas. Éstas catalizan la unión del azufre al cianuro irreversiblemente dando lugar a tiocianato, compuesto menos tóxico, que después se elimina por excreción renal. Estas reacciones metabólicas son de vital importancia en la detoxificación.
La tiosulfato-cianuro sulfotransferasa o Rodanasa es una enzima mitocondrial que transforma el cianuro en tiocianato al transferirle un átomo de azufre desde el tiosulfato, el cual actúa como grupo donador de azufre. Esta enzima tiene una actividad del 80% aproximadamente en riñón, hígado, cerebro, pulmón y músculo, entre otros. Otras enzimas sulfotransferasas que eliminan compuestos que contienen cianuro son β-mercaptopiruvato-cianuro sulfotransferasa (MPST), tiosulfato reductasa (tiosulfato tiol sulfotransferasa) y cistationasa γ-liasa.
El ser humano tiene una capacidad de detoxificación de 0,17 mg/kg/min. Las dosis letales medias son 1,52 mg/kg por vía oral, 100 mg/kg por vía dérmica y 524 ppm/10 min por vía inhalatoria. El metabolismo enzimático y la excreción por orina son eficaces en las intoxicaciones crónicas, pero en intoxicaciones agudas todos los compuestos dadores de azufre se saturan y la formación de cianatos se limita.
Aunque la principal forma de excreción es la orina, también puede existir la eliminación de trazas de cianuro por vía pulmonar como dióxido de carbono, salivar o sudorípara como β-tiocianoalanina.[3]
Referencias
- "Secondary Plant Compounds". En: Judd, W. S. Campbell, C. S. Kellogg, E. A. Stevens, P.F. Donoghue, M. J. 2002. Plant systematics: a phylogenetic approach, Second Edition. Sinauer Axxoc, USA. Capítulo 4; "Structural and Biochemical Characters".
- Hegnauer, R (1997). Cyanogenic compounds as systematic markers in Tracheophyta 1. Springer, Vienna. p. 191-209. ISBN 978-3-7091-7076-2. Consultado el 9 de noviembre de 2017.
- Bolarinwa, I; Oke, M; Olaniyan, S; Ajala, A (2016). «A Review of Cyanogenic Glycosides in Edible Plants». Toxicology - New Aspects to This Scientific Conundrum. doi:10.5772/64886. Consultado el 9 de noviembre de 2017.
- Quiroga, P; Olmos, V (2017). «Revisión de la toxicocinética y la toxicodinamia del ácido cianhídrico y los cianuros». Scielo.org.ar. Consultado el 10 de noviembre de 2017.
- Calvo, M (2017). «Glucósidos cianogenéticos». Bioquímica de los alimentos (Universidad de Zaragoza). Consultado el 9 de noviembre de 2017.
- González, JM (2017). «Glicósidos cianogénicos». Curso de biomoléculas (Universidad de País Vasco). Consultado el 9 de noviembre de 2017.
- Bak S, Paquette SM, Morant M, Morant AV, Saito S, Bjarnholt N, Zagrobelny M, Jørgensen K, Osmani S, Simonsen HT, P´erez RS, van Heeswijck TB, Jørgensen B and Møller BL (2006) Cyanogenic glycosides: a case study for evolution and application of cytochromes P450. PhytochemRev 5, 309–329.
- García, A; Carril, E (2009). «Metabolismo secundario de plantas». Serie Fisiología Vegetal. Consultado el 8 de noviembre de 2017.