Hexacarbonilo de cromo
El hexacarbonilo de cromo, Cr(CO)6, también conocido como cromo hexacarbonilo (traducción literal del inglés) o carbonilo de cromo, es un sólido estable al aire, a pesar de que tiene una presión de vapor alta y sublima fácilmente. El Cr tiene una carga formal cero, y se dice que es un complejo homoléptico, ya que todos los ligandos son el mismo. El complejo es octaédrico con distancias de enlace del Cr-C y C-O de 1,91 y 1,14 Å respectivamente.[2]
| hexacarbonilo de cromo | ||
|---|---|---|
6.png.webp) | ||
| Nombre IUPAC | ||
| hexacarbonilcromo(0) | ||
| General | ||
| Fórmula semidesarrollada | Cr(CO)6 | |
| Fórmula molecular | C6CrO6 | |
| Identificadores | ||
| Número CAS | 13007-92-6[1] | |
| ChEBI | 33031 | |
| ChemSpider | 23855 | |
| PubChem | 518677 | |
| Propiedades físicas | ||
| Apariencia | cristales incoloros | |
| Densidad | 1770 kg/m³; 1,77 g/cm³ | |
| Masa molar | 220 057 g/mol | |
| Punto de fusión | 90 °C (363 K) | |
| Punto de ebullición | 210 °C (483 K) | |
| Propiedades químicas | ||
| Momento dipolar | 0 D | |
| Peligrosidad | ||
| SGA |
 | |
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. | ||
Se trata de un complejo de 18-electrones tóxico y volátil, que debe manejarse con precaución.
Síntesis y obtención
El hexacarbonilo de cromo se obtiene por la reducción de cloruro de cromo(III) (CrCl3) en benceno con aluminio como agente reductor, y cloruro de aluminio como catalizador:[3]
- .
Tiene un buen rendimiento incluso en grandes cantidades en el autoclave.
Reactividad
Reacciones de sustitución
Los ligandos carbonilo (CO) pueden ser escindidos por oxidación térmica o fotoquímica. Los sitios de coordinación libres resultantes pasan a ser ocupados por moléculas de disolvente. Esto ocurre cuando se calienta este compuesto en disolventes aromáticos mediante la eliminación de tres ligandos carbonilo, sustituyéndolos por uno aromático:
Estas reacciones tienen lugar particularmente bien con arenos ricos en densidad electrónica, tales como el anisol, ya sea como el reactivo puro o utilizando una mezcla de THF y éter de dibutilo, este último para aumentar el punto de ebullición de la mezcla. Los productos adoptan una estructura de "taburete de piano". Estas especies son típicamente sólidos de color amarillo, que se disuelven bien en disolventes orgánicos comunes. El areno puede ser liberado de la cromo con yodo o por fotólisis en el aire. En general, los derivados sustituidos de Cr(CO)6 descomponen por exposición al aire.
Hay otros disolventes también son capaces de coordinarse al metal desplazando a los CO del complejo. Un ejemplo sería el THF:
Sínstesis de carbenos de Fischer
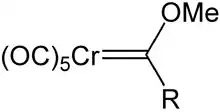
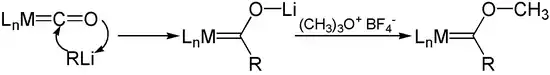
Los reactivos de organolitio se adicionan a los carbonilos metálicos para producir aniones acilo de carbonilo metálico. La O-alquilación de estos aniones, por ejemplo, con sales de Meerwein (tetrafluoroboratos o trialquiloxonios), proporciona carbenos de Fischer:[4]
Usos
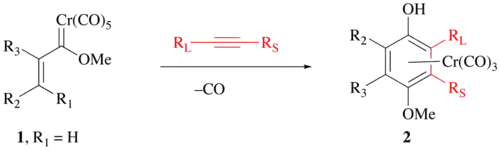
Una aplicación importante es la reacción de Dötz, en la síntesis de compuestos aromáticos tales como la vitamina E o vitamina K. Para esta reacción, se tiene que obtener primero un carbeno de Fischer del hexacarbonilo de cromo, que se hace reaccionar posteriormente con un alquino:[5]
Referencias
- Número CAS
- Whitaker A.; Jeffery, J. W. “The Crystal Structure of Chromium Hexacarbonyl” Acta Crystallographica 1967, volume 23, pp. 977-984. doi 10.1107/S0365110X67004153.
- Ernst Otto Fischer, Walter Hafner, Karl Öfele: „Über Aromatenkomplexe von Metallen, XXXI. Eine Synthese für Chromhexacarbonyl“, Chemische Berichte, Volume 92, Issue 12, S. 3050–3052, Dezember 1959; doi 10.1002/cber.19590921207.
- Elschenbroich, C. ”Organometallics” (2006) Wiley-VCH: Weinheim. ISBN 978-3-527-29390-2
- Dötz, K. H. (1975). «Synthesis of the Naphthol Skeleton from Pentacarbonyl-[methoxy(phenyl)carbene]chromium (O) and Tolan». Angew. Chem. Int. Ed. Engl. 14 (9): 644-645. doi:10.1002/anie.197506442.