Hidrógeno metálico
El hidrógeno metálico es una clase de materia degenerada, una fase del hidrógeno que se alcanzaría cuando, estando lo suficientemente comprimido, se comportase como un conductor eléctrico. Esta fase fue predicha en 1935 por Eugene Wigner y Hillard Bell Huntington.[2] Desde entonces, la obtención de hidrógeno metálico en el laboratorio se ha descrito como «el santo grial de la física de altas presiones».[3] Algunos investigadores proponen un límite inferior de presiones (alrededor de los 400 GPa, aunque este valor ha ido aumentando con el tiempo) en el que el hidrógeno metálico estaría en estado líquido, incluso a muy bajas temperaturas.[4][5]
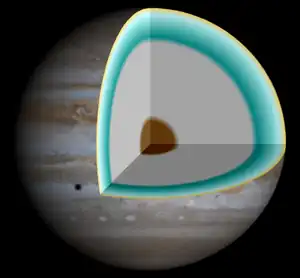
A altas presiones y temperaturas, el hidrógeno metálico podría existir como un líquido en lugar de un sólido, y los investigadores piensan que estaría presente en grandes cantidades gravitacionalmente comprimido en los interiores calientes de Júpiter, Saturno y en algunos planetas extrasolares.[6]
En octubre de 2016 distintas afirmaciones aseguraban que el hidrógeno metálico se había observado en el laboratorio a una presión de alrededor de 495 GPa. Estos resultados llevaron en enero de 2017 a científicos de la Universidad de Harvard a informar de la primera síntesis de hidrógeno metálico en un laboratorio, utilizando para alcanzar las altas presiones una celda de yunque de diamante.[7] Sin embargo, varios investigadores en este mismo campo dudaron de estos resultados.[8] Algunas observaciones consistentes con el comportamiento metálico habían sido publicadas anteriormente, como la observación de nuevas fases de hidrógeno sólido bajo condiciones estáticas de presión,[9][10] y, en el deuterio líquido denso, transiciones eléctricas aislante-conductor asociadas con un aumento de la reflectividad óptica.[11]
El hidrógeno metálico sólido consistiría en una red cristalina de núcleos de hidrógeno (es decir, protones), con un espaciado interatómico que sería significativamente menor que el radio de Bohr (de hecho, compararía mejor con la longitud de onda de De Broglie de los electrones). Los electrones del hidrógeno metálico no estarían ligados a sus núcleos y se comportarían como los electrones de conducción en un metal. Al igual que el dihidrógeno H2 molecular, el hidrógeno metálico sería un alótropo.
Historia
Metalización del hidrógeno bajo presión

Aunque el hidrógeno está en la parte superior de la columna de los metales alcalinos en la tabla periódica, no muestra, en condiciones normales, las propiedades de un metal alcalino. En su lugar, forma moléculas H2 diatómicas, análogas a los halógenos y los no metales de la segunda fila de la tabla periódica, como el nitrógeno y el oxígeno. El hidrógeno diatómico es un gas que, a presión atmosférica, se licúa y solidifica sólo a temperaturas muy bajas (20 grados y 14 grados sobre el cero absoluto, respectivamente). En 1935, sin embargo, los físicos Eugene Wigner y Hillard Bell Huntington predijeron que sometido a una presión alta de ~25 GPa (250.000 bar), el hidrógeno mostraría propiedades metálicas: en lugar de moléculas de H2 discretas (que consisten en dos electrones enlazados entre dos protones), una fase sólida se formaría con una red cristalina de protones y con los electrones deslocalizados en ella.[2] Desde entonces, la obtención de hidrógeno metálico en el laboratorio se ha descrito como «el santo grial de la física de altas presiones».[3]
La predicción inicial sobre la presión necesaria se demostró más tarde que era demasiado baja.[12] Después del primer trabajo de Huntington y Wigner, los cálculos teóricos más modernos apuntan hacia presiones de metalización mucho mayores, aunque potencialmente accesibles. Se desarrollan técnicas para lograr presiones de hasta 500 GPa, una presión superior a la presión existente en el centro de la Tierra, con la esperanza de lograr obtener hidrógeno metálico.[13]
Hidrógeno líquido metálico
A presión normal y a temperaturas cercanas al cero absoluto, el Helio-4 es helio líquido, una consecuencia de su alta energía del punto cero (en inglés, zero-point energy o ZPE). Del mismo modo, la ZPE de los protones en un estado denso también es alta, y se espera que, a altas presiones, la energía asociada al ordenamiento disminuya (en relación con la ZPE). Neil Ashcroft y otros han avanzado que existe un punto de fusión máximo del hidrógeno comprimido, y que también puede haber una gama de densidades (a presiones próximas a los 400 GPa) en que el hidrógeno puede ser un metal líquido, incluso a bajas temperaturas.[14][15]
Superconductividad
En 1968, Neil Ashcroft sugirió que el hidrógeno metálico puede ser un superconductor a temperatura ambiente (~ 290 K), una temperatura muy superior a la de cualquier otro material candidato conocido. Esto se debería a la extremadamente alta velocidad del sonido a través de esta fase del hidrógeno y al fuerte acoplamiento esperado entre los electrones de conducción y las vibraciones de la red.[16]
Posibilidad de nuevos tipos de fluido cuántico
Actualmente se conocen varios «super» estados de la materia, como los superconductores, los líquidos y gases superfluidos, y los supersólidos. Egor Babaev predijo que si el hidrógeno y el deuterio tenían estados metálicos líquidos, podrían tener estados ordenados en dominios cuánticos que no podrían ser clasificados como superconductor o superfluido en el sentido usual, sino que representarían dos tipos nuevos posibles de líquidos cuánticos: «superfluido superconductor» y «superfluido metálico». Se predice que no tendrían las respuestas habituales a campos magnéticos externos y rotaciones, lo que podría representar una ruta para la verificación experimental de esos posibles nuevos estados de la materia. También se ha sugerido que bajo la influencia de campos magnético, el hidrógeno puede mostrar transiciones de fase desde la superconductividad a la superfluidez y viceversa.[17][18][19]
Dopaje con litio y otros metales
En 2009, Zurek et al. predijeron que la aleación LiH6 podría ser un metal estable a solo 1/4 de la presión necesaria para metalizar el hidrógeno, y que efectos similares podrían esperarse de las aleaciones de tipo LiHn y, posiblemente, de otras aleaciones del tipo XHn con X un metal alcalino, un lantánido o un actínido.[20]
Compresión por ondas de choque
En marzo de 1996, Bruno Giuliani y un grupo de científicos del Laboratorio Nacional Lawrence Livermore informó de que habían producido casualmente, durante un microsegundo y a temperaturas de miles de kelvins y presiones de más de un millón de atmósferas (> 100 GPa), y densidades de aproximadamente 0.6 g/cm³.[21] el primer hidrógeno metálico identificable.[22] El equipo no esperaba producir hidrógeno metálico, ya que no estaban utilizando hidrógeno sólido, que se creía necesario, y estaban trabajando a temperaturas superiores a las especificados por la teoría de la metalización. Varios estudios anteriores en que el hidrógeno sólido había sido comprimido en una celda de yunque de diamante a presiones de hasta 2.500.000 atm (~253 GPa), no confirmaron metalización detectable. El equipo había tratado simplemente de medir los cambios de conductividad eléctrica menos extremos que se esperaba ocurrieran. Los investigadores utilizaron un cañón de luz de gas de la década de 1960, originalmente empleado en los estudios de misiles guiados, para disparar una placa impactadora en un recipiente sellado que contenía una muestra de medio milímetro de espesor de hidrógeno líquido. El hidrógeno líquido estaba conectado mediante hilos conductores a un dispositivo de medición de la resistencia eléctrica. Los científicos encontraron que, cuando la presión aumentó a 1 400 000 atm (142 GPa), la energía asociada a la banda prohibida (bandgap), una medida de la resistencia eléctrica, se redujo a casi cero. La banda prohibida del hidrógeno en un estado no comprimido es de unos 15 eV, un aislante inequívoco, pero, cuando la presión aumentó de manera significativa, la banda prohibida cayó gradualmente a 0,3 eV. Dado que la energía térmica del fluido (debido a la compresión de la muestra, la temperatura era de unos 3000 K) era superior a 0,3 eV, el hidrógeno podría ser considerado metálico.
Otras investigaciones experimentales desde 1996
Se han realizado muchos experimentos para la producción de hidrógeno metálico en condiciones de laboratorio, con compresión estática y bajas temperaturas. Arthur Ruoff y Chandrabhas Narayana, de la Universidad de Cornell, en 1998,[23] y más tarde, Paul Loubeyre y René LeToullec, del Comisariado de la Energía Atómica (Francia), en 2002, han demostrado que a presiones similares a las del centro de la Tierra (3,2 a 3,4 millones de atmósferas o 324 a 345 GPa) y a temperaturas de 100-300 K, el hidrógeno no es todavía un verdadero metal alcalino, a causa de una banda prohibida mayor de cero. La búsqueda para obtener hidrógeno metálico en el laboratorio a baja temperatura y compresión estática continúa y también se está experimentando con el deuterio.[24] En 2004, Shahriar Badiei y Leif Holmlid, de la Universidad de Gotemburgo, demostraron que los estados metálicos condensados hechos de átomos excitados de hidrógeno (la materia de Rydberg) son promotores eficaces de hidrógeno metálico.[25]
Avances experimentales en 2008
El máximo teóricamente previsto de la curva de fusión (un requisito previo para el hidrógeno metálico líquido) fue descubierto por Shanti Deemyad e Isaac F. Silvera usando el calentamiento por pulsos de láser (pulsed laser heating).[26] La aleación rica en hidrógeno, silano (SiH4), fue metalizada y M.I. Eremets et al. encontraron que era superconductora, confirmando la temprana predicción teórica de Ashcroft.[27] En esta aleación rica en hidrógeno, incluso a presiones moderadas (a causa de una precompresión química) el hidrógeno forma una sub-red con una densidad correspondiente a la del hidrógeno metálico.
Experimento de calentamiento con láser de pulso, 2008
El máximo teóricamente predicho de la curva de fusión (el requisito previo para el hidrógeno metálico líquido) fue descubierto por Shanti Deemyad e Isaac F. Silvera usando un calentamiento mediante láser pulsado.[28] M.I. Eremets et al..[29] alegó que el silano molecular rico en hidrógeno (SiH4) se habría metalizado y convertido en superconductor. Esta afirmación se discute y sus resultados no se han repetido.[30][31]
Observación del hidrógeno líquido metálico, 2011
En 2011 Eremets y Troyan informaron haber observado el estado líquido metálico del hidrógeno y deuterio a presiones estáticas de 2 600 000.[9] Esta afirmación fue cuestionada por otros investigadores en 2012.[32][33]
Máquina Z, 2015
En 2015, los científicos de la Máquina Z (Z Pulsed Power Facility) anunciaron la creación de deuterio metálico.[34]
Comunicación de observación directa del hidrógeno metálico sólido, 2016
El 5 de octubre de 2016, Ranga Dias e Isaac F. Silvera de la Universidad de Harvard dieron a conocer alegaciones de evidencia experimental de que el hidrógeno metálico sólido había sido sintetizado en el laboratorio. Este manuscrito estaba disponible en octubre de 2016[35] y una versión revisada fue publicada posteriormente en la revista Science en enero de 2017.[36][7] En la versión preliminar del artículo, Dias y Silvera escriben:
Con una presión creciente observamos cambios en la muestra, pasando de transparente a negro, a un metal reflectante, este último estudiado a una presión de 495 GPa... la reflectancia utilizando un modelo de electrones libres de Drude para determinar la frecuencia del plasma de 30,1 eV a T=5.5 K, con una densidad portadora de electrones correspondiente a 6,7×1023 partículas/cm³, consistente con las estimaciones teóricas. Las propiedades son las de un metal. El hidrógeno metálico sólido ha sido producido en el laboratorio.With increasing pressure we observe changes in the sample, going from transparent, to black, to a reflective metal, the latter studied at a pressure of 495 GPa... the reflectance using a Drude free electron model to determine the plasma frequency of 30,1 eV at T =5.5 K, with a corresponding electron carrier density of 6.7×1023 particles/cm³, consistent with theoretical estimates. The properties are those of a metal. Solid metallic hydrogen has been produced in the laboratory.Dias & Silvera (2016)[35]
Silvera afirmó que no repetirían su experimento, ya que más pruebas podrían dañar o destruir su muestra existente, pero aseguraron a la comunidad científica que se estaban haciendo más pruebas.[37][8] Poco después de que la pretensión fuese publicada en Science, la división de noticias de Nature publicó un artículo en que otros físicos consideraban el resultado con escepticismo. Recientemente, miembros destacados de la comunidad de investigación de altas presiones han criticado los resultados alegados,[38] [39] [40] cuestionando las presiones declaradas o la presencia de hidrógeno a esas presiones declaradas. En febrero de 2017, se informó que la muestra de hidrógeno metálico se había perdido, dado que los yunques de diamante que la contenían se habían roto.[41]
Hidrógeno metálico en otros contextos
Astrofísica
Se piensa que el hidrógeno metálico está presente en grandes cantidades en el interior, gravitatoriamente comprimido, de Júpiter, Saturno y algunos de los planetas extrasolares recientemente descubiertos. Debido a que las predicciones anteriores sobre la naturaleza de estos interiores había dado por sentada la metalización a una presión mayor que la que ahora se sabe a que sucede, las predicciones deben ser de nuevo afinadas. Los nuevos datos indican que debe de existir mucho más hidrógeno metálico dentro de Júpiter del que se pensaba, que estaría cerca de la superficie, y que por lo tanto, el enorme campo magnético de Júpiter, el más fuerte de cualquier planeta del sistema solar, a su vez, se produciría cerca de la superficie.
Permeación del hidrógeno de los metales
Como se mencionó anteriormente, el silano (SiH4) comprimido forma una aleación metálica. Es bien sabido que el hidrógeno, en condiciones de presión normales, puede permear en un grado notable diversos metales ordinarios. En algunos metales (por ejemplo, el litio) ocurre una reacción química que produce un compuesto químico no-metálico (hidruro de litio). En otros casos, es posible que el hidrógeno, literalmente, haga aleaciones de sí mismo con el metal (algo análogo a la formación de la amalgama de mercurio). Ciertamente, se sabe que muchos metales siguen siendo metálicos (por ejemplo, el paladio), después de la absorción de hidrógeno —la mayoría se vuelven frágiles, pero muchas aleaciones comunes también son frágiles.
Aplicaciones
Energía nuclear
Un método de producir la fusión nuclear es la llamada fusión por confinamiento inercial, cuyo objetivo consiste en bombardear con rayos láser pellets de isótopos de hidrógeno. Una mejor comprensión del comportamiento del hidrógeno en condiciones extremas puede ayudar a aumentar el rendimiento de la energía.
Combustible
Tal vez sea posible producir cantidades sustanciales de hidrógeno metálico para fines prácticos. Ha sido teorizada[42] la existencia de un forma llamada «hidrógeno metálico metaestable», (en inglés, Metastable Metallic Hydrogen, conocida por su abreviatura como MSMH) que podría no volver inmediatamente a hidrógeno ordinario cuando fuese liberada de presión.
Además, el MSMH sería un combustible eficiente en sí, y también limpio, ya que únicamente daría agua como residuo final. Nueve veces más denso que el hidrógeno normal, emitiría una considerable energía cuando retornase a hidrógeno normal. Quemado más rápidamente, podría ser un propergol con casi cinco veces más eficiencia que el H2/O2 líquidos, el actual combustible del transbordador espacial.[43] Por desgracia, los experimentos anteriormente mencionados del Lawrence Livermore en los que se produjo hidrógeno metálico, fueron demasiado breves para determinar si la metaestabilidad era o no posible.[44]
En ciencia ficción
En el juego de rol de Eclipse Phase, el hidrógeno metálico es mencionado como propulsor de naves espaciales, especialmente para el aterrizaje en cuerpos planetarios y de transferencias orbitales de corto alcance.[45]
Véase también
- Hidrógeno sólido
- Hidrógeno pastoso
- Cronología de las tecnologías del hidrógeno
Notas
- Stevenson, D. J. (2008). «Metallic helium in massive planets». Proceedings of the National Academy of Sciences 105 (32): 11035-11036. Bibcode:2008PNAS..10511035S. PMC 2516209. doi:10.1073/pnas.0806430105.
- Wigner, E.; Huntington, H. B. (1935). «On the possibility of a metallic modification of hydrogen». Journal of Chemical Physics 3 (12): 764. Bibcode:1935JChPh...3..764W. doi:10.1063/1.1749590.
- «the holy grail of high-pressure physics», «High-pressure scientists 'journey' to the center of the Earth, but can't find elusive metallic hydrogen». Cornell News. 6 de mayo de 1998. Consultado el 2 de enero de 2010.
- Ashcroft N.W., (en inglés) The hydrogen liquids. (enlace roto disponible en Internet Archive; véase el historial, la primera versión y la última). J.Phys. A 12, A129-137 (2000).
- Bonev, S.A., Schwegler, E., Ogitsu, T., and Galli, G., (en inglés) A quantum fluid of metallic hydrogen suggested by first principles calculations. Nature 431, 669 (2004).
- Guillot, T.; Stevenson, D. J.; Hubbard, W. B.; Saumon, D. (2004). «Chapter 3: The Interior of Jupiter». En Bagenal, F.; Dowling, T. E.; McKinnon, W. B, eds. Jupiter: The Planet, Satellites and Magnetosphere. Cambridge University Press. ISBN 0-521-81808-7.
- Dias, R. P.; Silvera, I. F. (2017). «Observation of the Wigner-Huntington transition to metallic hydrogen». Science. arXiv:1610.01634. doi:10.1126/science.aal1579.
- Castelvecchi, D. (2017). «Physicists doubt bold report of metallic hydrogen». Nature. doi:10.1038/nature.2017.21379.
- Eremets, M. I.; Troyan, I. A. (2011). «Conductive dense hydrogen». Nature Materials 10 (12): 927-931. Bibcode:2011NatMa..10..927E. doi:10.1038/nmat3175.
- Dalladay-Simpson, P.; Howie, R.; Gregoryanz, E. (2016). «Evidence for a new phase of dense hydrogen above 325 gigapascals». Nature 529 (7584): 63-67. Bibcode:2016Natur.529...63D. doi:10.1038/nature16164.
- Knudson, M.; Desjarlais, M.; Becker, A. (2015). «Direct observation of an abrupt insulator-to-metal transition in dense liquid deuterium». Science 348 (6242): 1455-1460. Bibcode:2015Sci...348.1455K. doi:10.1126/science.aaa7471.
- Loubeyre, P.; et al. (1996). «X-ray diffraction and equation of state of hydrogen at megabar pressures». Nature (en inglés) 383: 702. doi:10.1038/383702a0.
- «Peanut butter diamonds on display» (en inglés). BBC News. 27 de junio de 2007. Consultado el 2 de enero de 2010.
- Ashcroft, N.W. (2000). Journal of Physics: Condensed Matter (en inglés) 12: A129. doi:10.1088/0953-8984/12/8A/314.
- Bonev, S.A.; et al. (2004). «A quantum fluid of metallic hydrogen suggested by first-principles calculations». Nature (en inglés) 431: 669. doi:10.1038/nature02968.
- Ashcroft, N.W. (1968). «Metallic Hydrogen: A High-Temperature Superconductor?». Physical Review Letters (en inglés) 21: 1748. doi:10.1103/PhysRevLett.21.1748.
- Babaev, E.; N.W. Ashcroft (2007). «Violation of the London law and Onsager–Feynman quantization in multicomponent superconductors». Nature Physics (en inglés) 3: 530. doi:10.1038/nphys646.
- Babaev, E.; A. Sudbø y N.W. Ashcroft (2004). «A superconductor to superfluid phase transition in liquid metallic hydrogen». Nature (en inglés) 431: 666. doi:10.1038/nature02910.
- E. (2002). «Vortices with fractional flux in two-gap superconductors and in extended Faddeev model». Physical Review Letters (en inglés) 89: 067001. doi:10.1103/PhysRevLett.89.067001.
- Zurek, E.; et al. (2009). «A little bit of lithium does a lot for hydrogen». Proceedings of the National Academy of Sciences (en inglés). doi:10.1073/pnas.0908262106.
- Nellis, W. J. (2001). «Metastable Metallic Hydrogen Glass». Lawrence Livermore Preprint UCRL-JC-142360. OSTI 15005772. «minimum electrical conductivity of a metal at 140 GPa, 0.6 g/cm³, and 3000 K ».
- Weir, S.T.; A.C. Mitchell y W. J. Nellis (1996). «Metallization of fluid molecular hydrogen at 140 GPa (1.4 Mbar)». Physical Review Letters (en inglés) 76: 1860. doi:10.1103/PhysRevLett.76.1860.
- Ruoff, A.L.; et al. (1998). «Solid hydrogen at 342 GPa: No evidence for an alkali metal». Nature (en inglés) 393: 46. doi:10.1038/29949.
- Baer, B.J. (2007). «Coherent anti-Stokes Raman spectroscopy of highly compressed solid deuterium at 300 K: Evidence for a new phase and implications for the band gap». Physical Review Letters (en inglés) 98: 235503. doi:10.1103/PhysRevLett.98.235503.
- Badiei, S.; L. Holmlid (2004). «Experimental observation of an atomic hydrogen material with H–H bond distance of 150 pm suggesting metallic hydrogen». Journal of Physics: Condensed Matter (en inglés) 16: 7017. doi:10.1088/0953-8984/16/39/034.
- Deemyad, S.; I.F. Silvera (Marzo de 2008). The melting line of hydrogen at high pressures (en inglés). arXiv:0803.2321.
- Eremets, M.I.; et al. (2008). «Superconductivity in hydrogen dominant materials: Silane». Science (en inglés) 319: 1506. doi:10.1126/science.1153282.
- Deemyad, S.; Silvera, I. F (2008). «The melting line of hydrogen at high pressures». Physical Review Letters 100 (15): 155701. Bibcode:2008PhRvL.100o5701D. PMID 18518124. arXiv:0803.2321. doi:10.1103/PhysRevLett.100.155701.
- Eremets, M. I. (2008). «Superconductivity in hydrogen dominant materials: Silane». Science 319 (5869): 1506-9. Bibcode:2008Sci...319.1506E. PMID 18339933. doi:10.1126/science.1153282.
- Degtyareva, O. (2009). «Formation of transition metal hydrides at high pressures». Solid State Communications 149 (39–40): 1583-1586. Bibcode:2009SSCom.149.1583D. arXiv:0907.2128. doi:10.1016/j.ssc.2009.07.022.
- Hanfland, M.; Proctor, J. E.; Guillaume, C. L.; Degtyareva, O.; Gregoryanz, E. (2011). «High-Pressure Synthesis, Amorphization, and Decomposition of Silane». Physical Review Letters 106 (9): 095503. Bibcode:2011PhRvL.106i5503H. PMID 21405634. doi:10.1103/PhysRevLett.106.095503.
- Nellis, W. J.; Ruoff, A. L.; Silvera, I. S. (2012). «Has Metallic Hydrogen Been Made in a Diamond Anvil Cell?». . «no evidence for MH».
- Amato, I. (2012). «Metallic hydrogen: Hard pressed». Nature 486 (7402): 174-176. Bibcode:2012Natur.486..174A. doi:10.1038/486174a.
- «Z machine puts the squeeze on metallic deuterium». Chemistry World. Consultado el 27 de enero de 2017.
- Dias, R.; Silvera, I. F. (2016). «Observation of the Wigner-Huntington Transition to Solid Metallic Hydrogen». .
- Crane, L. (26 de enero de 2017). «Metallic hydrogen finally made in lab at mind-boggling pressure». New Scientist. Consultado el 26 de enero de 2017.
- Lemmonick, S. (27 de enero de 2017). «There's Reason To Be Skeptical About Metallic Hydrogen». Forbes. Consultado el 28 de enero de 2017.
- Goncharov, A.F.; Struzhkin, V. V. (2017). «Comment on Observation of the Wigner-Huntington Transition to Solid Metallic Hydrogen». .
- Eremets, M.I.; Drozdov, A. P. (2017). «Comments on the claimed observation of the Wigner-Huntington Transition to Metallic Hydrogen». .
- Loubeyre, P.; Occelli, F.; Dumas, P. (2017). «Comment on: Observation of the Wigner-Huntington Transition to Metallic Hydrogen». .
- Johnston, Ian (13 de febrero de 2017). «World's only piece of a metal that could revolutionise technology has disappeared, scientists reveal». Independent.
- Nellis, W. J. (6 de febrero de 2001). Metastable Metallic Hydrogen Glass (en inglés) (UCRL-JC-142360). Lawrence Livermore National Lab., CA (US). Consultado el 12 de marzo de 2017.
- Cole, J.W.; I.F. Silvera (2009). «Metallic Hydrogen Propelled Launch Vehicles for Lunar Missions». AIP Conference Proceedings (en inglés) 1103: 117. doi:10.1063/1.3115485. (enlace roto disponible en Internet Archive; véase el historial, la primera versión y la última).
- Nellis, W.J. (2001). «Metastable Metallic Hydrogen Glass». Lawrence Livermore Preprint UCRL-JC-142360 (en inglés).
- Boyle, Rob; Cross, Brian; Graham, Jack; Jury, Adam. «11. Gear». Eclipse Phase: The Roleplaying Game of Transhuman Conspiracy and Horror (en inglés estadounidense). EUA: Posthuman Studios, LLC. p. 347. «Metallic hydrogen is a solid form of hydrogen created using exceedingly high pressures. (...) Metallic hydrogen engines are used in most planetary landers and short range vehicles. »
Enlaces externos
- Esta obra contiene una traducción derivada de «Metallic hydrogen» de Wikipedia en inglés, publicada por sus editores bajo la Licencia de documentación libre de GNU y la Licencia Creative Commons Atribución-CompartirIgual 4.0 Internacional.