Hielo
El hielo es agua en estado sólido, uno de los tres estados naturales del agua que forman parte de los cuatro estados de agregación de la materia. Se reconoce por su temperatura, su color blanco níveo y su flotabilidad. El agua pura se congela a 0 °C cuando se halla sometida a una atmósfera de presión.



El hielo es el nombre común del agua en estado sólido; otras denominaciones son la nieve, la escarcha, el granizo, etc.[1]
Volumen y densidad del agua al solidificarse
El agua es una de las pocas sustancias que al congelarse aumenta de volumen (por lo tanto disminuye su densidad);[2] es decir, se expande. Esta propiedad evita que los océanos de las regiones polares de la Tierra se congelen en todo su volumen, puesto que el hielo flota en el agua y es lo que queda expuesto a los cambios de temperatura de la atmósfera. La densidad típica del hielo a 0 °C suele tomarse como 0,916 g/cm³; o como 916,8 kg/m³ .
Estructura cristalina

El hielo se presenta en 12 estructuras o fases cristalinas diferentes. A las presiones habituales en el medio terrestre (en el entorno de la presión atmosférica), la fase estable suele denotarse como fase I según la terminología de Tamman. Dicha fase I presenta dos variantes relacionadas entre sí: el hielo hexagonal, denotado Ih, y el hielo cúbico, Ic. El hielo hexagonal es la fase más común, y la mejor conocida: su estructura hexagonal puede verse reflejada en los cristales de hielo, que siempre tienen una base hexagonal. El hielo cúbico Ic se obtiene por deposición de vapor de agua a temperaturas inferiores a –130 °C, por lo que no es tan común; aun así, a unos –38 °C y 200MPa de presión, situación esperable en los casquetes polares, ambas estructuras están en equilibrio termodinámico.

El hielo Ih presenta una estructura hexagonal en la que cada átomo de oxígeno de una molécula de agua tiene otros cuatro átomos de hidrógeno como sus vecinos más próximos, situados en los vértices de un tetraedro regular cuyo centro es el átomo de oxígeno de interés. Esta unidad tetraédrica es común a todas las demás fases del hielo, y se debe al hecho de que el ángulo entre átomos de hidrógeno en la molécula de agua libre H-O-H es de 104,52°, en vez de 90°. El ángulo tetraédrico entre O-O-O es de 109,47°. Para temperaturas de interés terrestre, la distancia entre átomos de oxígeno O-O es de 0,276 nm y entre O-H de 0,0985 nm. La unión entre átomos intramoleculares es de enlaces covalentes simples y por tanto muy estables, mientras que la unión intermolecular se produce por enlaces de puente hidrógeno relativamente débiles, lo cual explica la relativamente baja temperatura de fusión del hielo. Los parámetros de red más relevantes son el lado hexagonal a=0,451 nm, y la altura del prisma hexagonal c=0,7357 nm. Estos valores pueden variar ligeramente con la temperatura, pero la relación entre ambos, c/a=1,628, permanece prácticamente estable y muy cercana al valor óptimo de c/a=1,633, teorizado para esferas sólidas en contacto formando la misma estructura hexagonal. La estabilidad del parámetro c/a explica el hecho de que la expansión térmica del hielo se produzca de manera isotrópica. Por su parte, el hecho de que el hielo Ih tenga una estructura hexagonal explica la anisotropía usualmente observada en sus propiedades mecánicas: el módulo de Young, por ejemplo, que se sitúa en el entorno de E=9-10GPa para cristales puros, presenta isotropía radial, y varía considerablemente según la dirección de la deformación; la resistencia mecánica, situada en el entorno de 1MPa para cristales puros en la dirección basal, puede alcanzar los 7MPa en ciertas configuraciones. La presencia de impurezas en la red es práula, salvo para algunas sustancias puntuales como el fluoruro de amonio, NH4F. Los defectos cristalinos pueden ser cuatro: vacantes, intersticiales, iónicos o de Bjerrum, los dos últimos siendo exclusivos del hielo y estando relacionados con la rotación de hidrógenos de una molécula de agua en la red.
En todo caso, la estructura Ih del hielo es poco compacta —lo cual explica su menor densidad con respecto a la fase líquida— sobre todo si se compara con estructuras análogas en otros materiales cristalinos como los metales. El factor de empaquetamiento es de 0,34, muy inferior al 0,74 típico de los metales. Ello se explica por la repulsión de átomos de hidrógeno y oxígeno conforme se compacta la red. De hecho, esta repulsión lleva a que, cuando la presión sobre la red hexagonal es lo suficientemente elevada, esta estructura deje de ser estable y aparezcan otras que la sustituyan.
En efecto, el resto de fases cristalinas se producen a presiones mucho más altas, y hasta 1900 eran desconocidas. De hecho, no existen en la Tierra, pues los casquetes polares terrestres son demasiado finos como para permitir la aparición de fases estables distintas al hielo Ih. Sin embargo, la situación es distinta en las grandes lunas heladas del sistema solar como Europa o Tritón, donde se postula que las presiones en el núcleo son lo suficientemente elevadas como para asegurar la aparición de fases estables distintas a la Ih, que a dichas presiones sería inestable. Las fases cristalinas de alta presión mejor conocidas son las fases II y III; en laboratorio solo se han estudiado las fases II, III, V y VI,[3] mientras que el resto permanecen básicamente desconocidas.
La estructura del hielo II es romboidal. Este hielo se forma a unos 238K para presiones de 283 atmósferas, y su densidad es de 1193 kg/m³ por ser una estructura mucho más compacta. El hielo III es tetragonal, y aparece a unos 246 K y 276 atm, siendo su densidad de 1166 kg/m³. El hielo V es monoclínico, aparreciendo a 237,5 K y 480 atm, con una densidad de 1267 kg/m³. El hielo VI es tetragonal, y aparece a 237,5K para 777atm, con una densidad de 1360 kg/m³. Todas estas fases son esencialmente frágiles, aunque presentan gran tendencia a la fluencia en el tiempo (creep) y cierto comportamiento viscoelástico.
Aunque inicialmente se creía que eran fases nanocristalinas, aparte de las fases cristalinas arriba mencionadas, el hielo puede aparecer en dos fases amorfas (vítreas): el hielo amorfo de baja densidad (940 kg/m³ a –196 °C y 1atm) y el hielo amorfo de alta densidad (1170 kg/m³, mismas condiciones). La formación del hielo amorfo es complicada, y se relaciona con el tiempo de solidificación dado al agua; puede formarse por condensación de vapor por debajo de –160 °C, por colapso de la estructura Ih bajo elevada presión por debajo de –196 °C. En todo caso, salvo en ciertas situaciones muy concretas, no son fases comunes en la Tierra.
El hielo como mineral
| Hielo mineral | ||
|---|---|---|
 | ||
| General | ||
| Categoría | Minerales óxidos | |
| Clase | 4.AA.05 (Strunz) | |
| Fórmula química | H2O | |
| Propiedades físicas | ||
| Color | Incoloro a blanco | |
| Raya | Blanca | |
| Lustre | Vítreo | |
| Transparencia | Transparente | |
| Sistema cristalino | Hexagonal | |
| Fractura | Concoidea | |
| Dureza | 1,5 (Mohs) | |
| Tenacidad | Quebradizo | |
| Densidad | 0,917 g/cm³ | |
| Magnetismo | Diamagnético | |
| Variedades principales | ||
| Nieve | ||
En mineralogía es aceptado como mineral válido por la Asociación Mineralógica Internacional, pues es un sólido estable a temperaturas de menos de 0 °C. Se clasifica en el grupo 4 de minerales óxidos al ser un óxido de hidrógeno, normalmente con abundantes impurezas.[4]
Tipos de hielo
Como en la mayoría de los sólidos, en el hielo las moléculas se acomodan en una formación ordenada. Sin embargo, dependiendo de las condiciones de presión y temperatura, es posible que adopten diferentes formas de ordenarse. A partir de 1900, Gustave Tamman y posteriormente en 1912 Percy Bridgman hicieron experimentos sobre el hielo aplicándole diferentes presiones y temperaturas, y obtuvieron hielos diferentes con mayores densidades que la normal (posteriormente se encontraron muchos más tipos de hielo). Todas estas formas de hielo tienen estructuras más compactas (diferentes formas de un elemento existentes en el mismo estado físico), o sea que se forman varias modificaciones alotrópicas o alótropos.
Los tipos de hielo conocidos son los siguientes:
- MDA o hielo amorfo de densidad media, se caracteriza por no tener una estructura cristalizada y ser más similar en estructura molecular al agua líquida que a cualquier otro tipo de hielo conocido. Además, tiene la misma densidad que el agua líquida.
- Hielo Ih (Todo el hielo que se forma en la biosfera terrestre es hielo del tipo Ih, a excepción de una pequeña cantidad de hielo Ic. Los cristales de hielo tienen forma hexagonal).
- Hielo Ic (baja temperatura, cúbica centrada en las caras, densidad aproximadamente 900 kg/m³).
- Hielo II (baja temperatura, ortorrómbica centrado, densidad aproximadamente 1200 kg/m³).
- Hielo III o Iii (baja temperatura, tetragonal, densidad aproximadamente 1100 kg/m³).
- Hielo V (alta presión, baja temperatura, monoclínica de base centrada, densidad aproximadamente 1200 kg/m³).
- Hielo VI (alta presión, baja temperatura, tetragonal, densidad aproximadamente 1300 kg/m³).
- Hielo VII (alta temperatura, alta presión, cúbico sencilla, densidad aproximadamente 1700 kg/m³).
- Hielo VIII (alta presión, tetragonal centrada, densidad aproximadamente 1600 kg/m³).
- Hielo IX (alta presión, tetragonal, densidad aproximadamente 1200 kg/m³).
- Hielo XII (alta presión, baja temperatura, tetragonal, densidad aproximadamente 1300 kg/m³).
Fusión eutéctica
En las condiciones terrestres y durante invierno es frecuente agregar sal al hielo para que se funda. De hecho, lo que se funde no es el hielo, sino un compuesto de hielo y sal llamado «eutéctico». Cuando la sal NaCl (Na+, Cl–) entra en contacto con el hielo, los iones se arreglan alrededor de las moléculas de agua, que son polares (H2δ+, Oδ–) y viene a formar un compuesto (H2O).(NaCl). Para este rearreglo hacen falta solamente unos pequeños movimientos de átomos, y se hace por lo tanto en fase sólida. Cuando se respetan las proporciones exactas (alrededor del 23 % de sal en masa), se tiene un producto que se comporta como producto puro (particularmente, hay una temperatura de fusión constante) y que se califica de «eutéctica». La temperatura de fusión de esta eutéctica es de alrededor de –21 °C.
Si la proporción de sal es inferior a esta relación, se da una mezcla agua-eutéctica, que se funde a una temperatura superior (entre –21 °C y 0 °C). Si la proporción de sal es superior, se tiene una mezcla sal-eutéctica que también se funde a una temperatura superior. Se puede trazar un diagrama, llamado diagrama de fase, que representa la temperatura de fusión en función de las proporciones agua-sal.
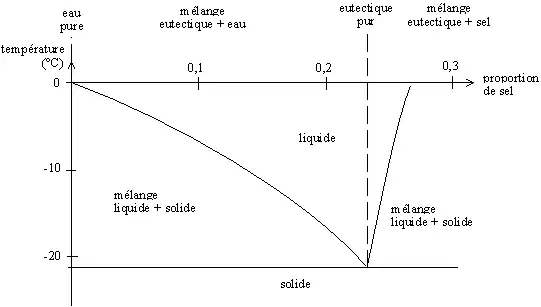
Diagrama de fase agua-sal a presión atmosférica; la eutéctica se forma en una proporción de agua de 0,2331 en masa (23,31 % de sal y 76,69 % de agua en masa).
El «arreglo» agua + sal → eutéctica no puede darse sino en los puntos de contacto entre los cristales de hielo y de sal, o sea en la superficie del hielo. Se forma así una capa superficial de eutéctica que se funde (si la temperatura es superior a –21 °C). Como la sal está en sobresaturación, se disuelve en la eutéctica fundida y puede reaccionar con el hielo que se encuentra sobre la película líquida. El fenómeno se propaga entonces hasta que falta agua o sal para formar una nueva eutéctica. Así, en teoría, sería posible impedir la formación de hielo hasta los –21 °C. En la práctica, es imposible dosificar la cantidad de sal que debe usarse.
Descenso crioscópico
El descenso crioscópico es la reducción del punto de fusión de un disolvente puro por la presencia de solutos. Es directamente proporcional a la molalidad, lo que hace que sea más importante para solutos iónicos, como los que predominan en el agua de mar, que para los no iónicos. El fenómeno tiene importantes consecuencias en el caso del agua de mar, porque la respuesta al enfriamiento intenso del agua del océano, como ocurre en el invierno de las regiones polares, es la separación de una fase sólida flotante de agua pura en forma de hielo. Es así como se forma la banquisa en torno a la Antártida o al océano Ártico, como un agregado compacto de hielo puro de agua, con salmuera llenando los intersticios, y flotando sobre una masa de agua líquida a menos de 0 °C (hasta un límite de –1,9 °C para una salinidad del 3,5 %).
El color del hielo
En ciertas ocasiones el hielo se ve de color azul.

La luz blanca del Sol está realmente formada por una mezcla de colores, desde el rojo al violeta, como se comprueba cuando se hace pasar un rayo de luz a través de un prisma de vidrio, o en el arco iris. Las ondas de luz más azuladas tienen más energía que las amarillas o las rojas. La nieve es blanca porque toda la luz que le llega es reflejada en una capa muy delgada que se encuentra en su superficie. Las pequeñas burbujas de aire que están atrapadas en el hielo reflejan la luz múltiples veces y todos los colores, desde el rojo al violeta, escapan, de modo que la luz que recibimos es luz blanca. El hielo aparece azul cuando tiene una consistencia muy alta y las burbujas de aire no impiden el paso de la luz a través de él. Sin el efecto «dispersivo» de las burbujas, la luz puede penetrar en el hielo siendo absorbida paulatinamente en su camino hacia las partes más profundas. Los fotones rojos, que tienen menor energía que los azules, penetran menos distancia y son absorbidos antes. En promedio, la absorción de luz roja en el hielo es seis veces más eficiente que la absorción de luz azul; por tanto, cuanta más distancia viaje un haz de luz blanca, pierde en su camino más y más fotones rojos, amarillos, verdes… y son los azules los que «sobreviven». Esta es la razón del color azul del hielo puro, y de un glaciar o de un iceberg.
Dicho de otra manera, el hielo más compacto, como el hielo glaciar, se comporta de una forma especial al recibir la luz. Al incidir un rayo de luz, solo el componente azul de la radiación solar tiene la suficiente energía para penetrar en el interior de la masa de hielo. Por ello, al absorber los otros colores, el hielo glaciar aparece de color azul.
Otras acepciones
Por extensión se usa el nombre hielo para otro tipo de compuestos químicos. Así, por ejemplo, se habla de hielo seco para referirse al estado sólido del anhídrido carbónico (dióxido de carbono o CO2).
Acción erosiva
La expansión del agua al solidificarse tiene efectos geológicos importantes. El agua que se introduce en las grietas diminutas de las rocas de la superficie terrestre crea una enorme cantidad de presión al solidificarse y parte o rompe las rocas. Esta acción del hielo desempeña un papel importante en la erosión. Además los glaciares, mediante fricción, pulen el terreno por donde circulan.
Formaciones de hielo sin agua

Las fases sólidas de algunas otras sustancias también reciben el nombre de hielo, sobre todo en el contexto astrofísico: el hielo seco es un término comúnmente utilizado para el dióxido de carbono sólido.
Un monopolo magnético de hielo también se puede llevar a cabo al aislar los materiales magnéticos en los cuales los momentos magnéticos imitan la posición de los protones en el agua de hielo y se rigen por limitaciones energéticas similares a las reglas de Bernal-Fowler, derivados de la frustración geométrica en la configuración de un protón en el hielo de agua. A estos materiales se les denomina hielos de espín.
Volumen de agua al derretirse
Cuando una masa de hielo que se encuentra flotando se derrite, el nivel del agua no aumenta.[5] Esto se debe a que en todo momento el volumen de agua que potencialmente una masa de hielo puede generar al derretirse es igual al volumen de hielo que se encuentra sumergido en ese momento.
El peso de una masa de hielo es:
El empuje de Arquímedes que recibe es:
Igualando ambos términes haciendo equilibrio de fuerzas llegamos a:
Error al representar (SVG (MathML puede ser habilitado mediante un plugin de navegador): respuesta no válida («Math extension cannot connect to Restbase.») del servidor «http://localhost:6011/es.wikipedia.org/v1/»:): {\displaystyle V_{s}=\frac{\rho_{h}}{\rho_{a}}V_{hielo} }
Lo que relaciona el volumen sumergido con el volumen total de hielo existente.
Para demostrar que el volumen de hielo que se derrite es igual al que se sumerge primero aplicamos conservación de la masa:
Error al representar (SVG (MathML puede ser habilitado mediante un plugin de navegador): respuesta no válida («Math extension cannot connect to Restbase.») del servidor «http://localhost:6011/es.wikipedia.org/v1/»:): {\displaystyle M_{hielo}=\rho_{h}V_{hielo}=\rho_{a} V_{derretido} }
Introduciendo los valores calculados anteriormente llegamos a:
Error al representar (SVG (MathML puede ser habilitado mediante un plugin de navegador): respuesta no válida («Math extension cannot connect to Restbase.») del servidor «http://localhost:6011/es.wikipedia.org/v1/»:): {\displaystyle V_{derretido}=\frac{ \rho_{h} }{ \rho_{a} } * \frac{\rho_{a}}{\rho_{h}}V_{s} =V_{s} }
Demostrando la equivalencia de volumen.
Si el nivel del agua no varía... ¿Por qué dicen que al derretirse los polos aumentará el nivel de los océanos?[6]
Hemos visto que si una masa de hielo flotante se derrite no afectará al nivel del agua. Sin embargo, si el hielo que se derrite se encuentra sobre tierra firme, sí. La Antártida por ejemplo es un continente cubierto completamente por hielo que descansa sobre tierra firme. Por lo tanto, si se derrite el hielo y/o se desprende algún fragmento de hielo al océano, incrementará el nivel del agua.
Véase también
- Aguanieve
- Banquisa
- Carámbano
- Cometa
- Congelación atmosférica
- Difluencia glaciar
- Dióxido de carbono
- Escalada en hielo
- Escarcha
- Exclusión de salmuera
- Glaciar
- Glaciar de circo
- Glaciar de valle
- Glaciología
- Granizo
- Helada
- Hidrato de gas
- Hielo azul
- Hielo VII
- Iceberg
- Nieve
- Perdigones de hielo
- Permafrost
- Prismas de hielo
- Rimaya
- Serac
- Valle glaciar
Referencias
- Aguilera Mochón, J.A. (2017) El agua en el cosmos, p. 30.
- Serway, Raymond A.; Faughn, Jerry S. (2001). Física. Pearson Educación. ISBN 978-970-26-0015-2. Consultado el 26 de diciembre de 2019.
- Schulson, Erland M. Creep and Fracture of Ice, Cambridge University Press, 2009. ISBN 978-0-521-80620-6
- Hielo mineral en mindal.org.
- Si se derrite el hielo, ¿Aumenta el nivel de agua? Demostración matemática
- «Si el nivel de agua no varía, ¿Por qué se habla del hielo de los polos y el nivel del agua?».
Enlaces externos
 Wikimedia Commons alberga una categoría multimedia sobre Hielo.
Wikimedia Commons alberga una categoría multimedia sobre Hielo. Wikcionario tiene definiciones y otra información sobre hielo.
Wikcionario tiene definiciones y otra información sobre hielo.