Hiperplasia benigna de próstata
La hiperplasia benigna prostática (HBP) consiste en un crecimiento no maligno (no cancerígeno) en el tamaño de la próstata. Este aumento del tamaño de la glándula prostática es producto del estímulo androgénico.[cita requerida]
| Hiperplasia benigna de próstata | ||
|---|---|---|
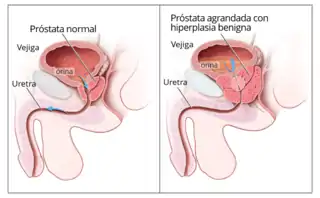 Diagrama ilustrando una próstata normal (izq.) y una hiperplasia benigna de próstata (der.) | ||
| Especialidad | urología | |
La próstata, al crecer, puede ir comprimiendo progresivamente la uretra y provocar, por tanto, dificultad al orinar. Esto sucede porque esta compresión impide el flujo de la orina desde la vejiga hacia la uretra hasta el exterior. Las posibles consecuencias son retenciones de orina en la vejiga o reflujo de la orina hacia los riñones y una necesidad de orinar frecuentemente. Si la inflamación fuera muy grave, puede bloquearse por completo el sistema urinario.
La HBP es una enfermedad muy común en los hombres: aunque generalmente comienza a partir de los 30 años, es muy raro que se manifieste antes de los 40. A los 60 años, aproximadamente, más del 50% de los hombres padece HBP y entre los 70 y 80 años hasta el 90% presenta alguno de sus síntomas.
Diagnóstico diferencial
El diagnóstico diferencial con el adenocarcinoma de próstata se establece a través de:
- cuantificación de antígeno prostático específico (PSA) en sangre: se cuantifica tanto el valor total como la relación entre PSA libre y PSA total
- ecografía prostática e índice prostático: se cuantifica el tamaño de la próstata y se relaciona con el PSA. El mayor tamaño es sugestivo de hipertrofia benigna de próstata.
Entre otras pruebas, el tacto rectal ayuda a determinar si se trata de una patología benigna o maligna.
Por último la prueba más fiable es la biopsia prostática, aunque es de gran complejidad en algunas ocasiones diferenciar el adenocarcinoma de la hipertrofia benigna de próstata.
Su pronóstico es bueno, suele provocar un síndrome miccional y el tratamiento con antiandrógenos suele tener buenos resultados en el caso de que la próstata sea mayor de 40 g, pero el tratamiento farmacológico siempre es tendiente a mejorar o disminuir los síntomas obstructivos e irritativos que son los que deterioran la calidad de vida de los pacientes. Este tratamiento a los síntomas se hace con alfabloqueadores, que relajan el músculo liso de la uretra y relajan la vejiga permitiendo una evacuación de orina casi normal y a su vez evitan la complicación más importante que es la retención urinaria aguda (RAO).
Salvo elevación marcada del antígeno prostático específico (PSA) en sangre, a valorar, es siempre el paciente el que indica la conveniencia de la intervención quirúrgica, en lo cual es difícil aconsejarle porque su conveniencia es función fundamentalmente de sus molestias.
Cuadro clínico
Síntomas
Sus síntomas se clasifican como obstructivos (o de vaciado) e irritativos (o de llenado) Los obstructivos incluyen vacilación, intermitencia, vaciado incompleto, chorro débil y goteo post-miccional.
Los síntomas por los que consulta más el paciente son los irritativos, e incluyen frecuencia de orinar, llamada nicturia (despertarse para orinar varias veces por la noche) cuando ocurre en horarios nocturnos, y urgencia (sensación de orinar urgente, cuando no es necesario). Esos síntomas obstructivos e irritativos se evalúan usando el cuestionario Score Internacional de Síntomas de Próstata (IPSS), diseñado para juzgar la severidad del HBP.[1]
La HBP es una enfermedad progresiva, lo que quiere decir que puede evolucionar si no se le trata. El vaciado incompleto resulta en acumulación de bacterias en los residuos de la vejiga y un riesgo incrementado de infección urinaria. Se forman cálculos renales a partir de la cristalización de sales en la orina residual. Otras formas de progresión de la enfermedad son la retención urinaria aguda. Esa retención aguda es la incapacidad del vaciado, y la retención crónica es el volumen residual de orina que gradualmente se incrementa, y la vejiga se distiende. Algunos pacientes que la sufren pueden finalmente progresar hacia un fallo renal, una condición de uropatía obstructiva.
- Uropatía obstructiva
- Retención urinaria
- ITU
- Litiasis
- Polaquiuria
- Nicturia
- Dificultad para iniciar la micción
- Disuria de esfuerzo
- Goteo postmiccional
Etiología
Muchos expertos consideran que los andrógenos (testosterona y hormonas vinculadas) juegan un rol facilitante en la HBP. Los andrógenos están involucrados en el desarrollo de la HBP, como indica el hecho de que los hombres castrados (no productores de andrógenos) no desarrollen dicha enfermedad. Sin embargo, se desconoce la causa del desequilibrio hormonal presente en la HBP[2]. La dihidrotestosterona (DHT), un metabolito de la testosterona, es un crítico mediador del crecimiento prostático. La DHT es sintetizada en la próstata desde testosterona circulante por la acción de la enzima 5α-reductasa, tipo 2. Esta enzima se localiza principalmente a partir las células del estroma; esas células son el principal sitio de síntesis de DHT.
El DHT puede actuar en la liberación autocrina en las células del estroma o en la liberación paracrina por difusión en las cercanas células epiteliales. En ambos tipos de células, el DHT enlaza los receptores de andrógenos nucleares y las señales de la transcripción genética del factor de crecimiento que son mitogénicos a las células del epitelio y del estroma. El DHT es 10 veces más potente que la testosterona debido a que se disocia del receptor androgénico más lentamente. La importancia del DHT en causar hiperplasia nodular se apoya en las observaciones clínicas en las que un inhibidor de la 5α-reductasa se da a hombres con esta condición. La terapia con el inhibidor 5α-reductasa reduce marcadamente el contenido de DHT de la próstata y reduce el volumen prostático y, en muchos casos, los síntomas de HBP.
Hay evidencia sobre crecimiento de que los estrógenos actúan en la etiología de la HBP; basado en que ella ocurre cuando el hombre generalmente tiene elevados niveles de estrógeno y relativamente reducidos los de testosterona libre, y cuando los tejidos prostáticos pasan a ser más sensibles a estrógenos y de menos respuesta a DHT. Las células tomadas de próstatas de sujetos que tienen HBP muestran que crecen en respuesta a niveles altos de estradiol y bajos niveles de andrógenos. Los estrógenos pueden dar células más susceptibles a la acción de DHT.
A nivel microscópico, la HBP puede verse en una vasta mayoría de hombres al envejecer, particularmente pasados los 70 años, en todo el mundo. Sin embargo, en las tasas clínicamente significativas, la HBP varía sintomatológicamente de manera clara dependiendo del estilo de vida. Los occidentales tienen mucha mayor incidencia de HBP sintomática que la de aquellos con un estilo de vida tradicional o rural. Esto se confirma por estudios en China que muestran cómo los sujetos que viven en áreas rurales presentan tasas muy bajas de HBP clínica, mientras los que viven en la ciudad adoptando formas de vida europea tienen una incidencia de HBP mucho más alta, aunque manteniendo tasas bajas en relación con lo visto en Occidente.
Falta mucha investigación por hacer para clarificar completamente las causas de la HBP.
Diagnóstico
El tacto rectal (palpación de la próstata a través del recto) puede revelar una próstata marcadamente agrandada y asperezas de textura que pudieran ser síntoma de cáncer.
Con frecuencia, se realizan análisis de sangre para testear la malignidad de la hiperplasia de la próstata: niveles altos de antígeno prostático específico (PSA) dan pie a posteriores estudios, tales como reinterpretación del resultado del PSA, en términos de densidad y % libre de PSA, tacto rectal, ultrasonografía transrectal, etc. Esas medidas combinadas pueden dar lugar a una detección temprana de cáncer.
El examen ecográfico de testículos, próstata y riñones ayuda a diferenciar malignidades e hidronefrosis.
Epidemiología
Más de la mitad de la población masculina de EE. UU. entre los 60 y 70 y el 90% entre los 70 y 90 años tienen síntomas de HBP. Para algunos hombres, los síntomas pueden ser severos al punto de requerir tratamiento.
Tratamiento
Estilo de vida
Los pacientes deberán disminuir la ingesta de líquidos antes de acostarse, y además moderar el consumo de alcohol y de cafeína. Aunque se han obtenido resultados disímiles en distintos estudios, los más recientes indican una correlación positiva entre la ingesta de cafeína y el riesgo de hiperplasia benigna de próstata, a la vez que se verifica una correlación negativa entre el consumo moderado de alcohol, en particular vino tinto, y la citada enfermedad.[3]
El resultado positivamente eficaz se manifiesta si la persona enferma incluye en su actividad diaria la práctica de ejercicio físico específicamente designado para la enfermedad: en concreto, gimnasia dirigida al mejoramiento de la circulación de sanguínea en la región pélvica, en combinación con ejercicios de respiración diafragmática, correr o caminar a paso ligero al aire libre, la natación activa. La utilidad del movimiento se refuerza por la realización de la relajación ulterior.
Una revisión Cochrane de 2019 de seis estudios que involucran a 652 sujetos que evalúan los efectos de la actividad física sola, la actividad física como parte de un programa de autocuidado, entre otros. Sin embargo, la calidad de las pruebas fue muy baja y, por lo tanto, no se sabe si la actividad física es útil para experimentar los síntomas urinarios causados por la hiperplasia prostática benigna.[4]
Medicaciones
Los inhibidores de 5α-reductasa (finasteride y dutasteride) alivian las causas de la HBP, y son una opción de tratamiento. Pacientes con próstatas agrandadas notan una reducción del progreso de la HBP y una reducción en retención aguda urinaria o con finasteride o con dutasteride. Una combinación simultánea de finasteride con dutasteride podría causar un elevado número de efectos adversos relacionados con la esfera sexual y provocar cansancio generalizado.[5]
Los bloqueadores α1 selectivos son la opción más común para el tratamiento inicial.[6][7][8] Incluyen alfuzosina,[9][10] doxazosina,[11] silodosina, tamsulosina, terazosina y naftopidil.[12] Tienen un beneficio de pequeño a moderado para mejorar los síntomas.[13][12][14] Los bloqueadores alfa-1 selectivos tienen una eficacia similar, pero tienen perfiles de efectos secundarios ligeramente diferentes.[13][12][14] Los alfabloqueantes relajan el músculo liso de la próstata y el cuello de la vejiga, lo que reduce el bloqueo del flujo de orina. Los efectos secundarios comunes de los alfabloqueantes incluyen hipotensión ortostática (un ataque de cabeza o mareos al levantarse o estirarse), cambios en la eyaculación, disfunción eréctil,[15] dolores de cabeza, congestión nasal y debilidad. Para los hombres con síntomas del tracto urinario inferior debido al agrandamiento de la próstata, los efectos del naftopidil, la tamsulosina y la silodosina sobre los síntomas urinarios y la calidad de vida serían similares.[12] El naftopidil y la tamsulosina pueden tener niveles similares de efectos secundarios sexuales no deseados, pero menos efectos secundarios no deseados que la silodosina.[12]
Actualmente se encuentran los alfabloqueantes, como tamsulosina, combinados con solifenacina. Esta combinación ha demostrado gran eficacia y una reducción significativa en el control de los síntomas irritativos o de llenado: urgencia miccional, frecuencia y nocturia. El sildenafil muestra algún alivio sintomático, sugiriendo una posible común etiología con la disfunción eréctil.[16]
Una revisión Cochrane de 2018 de estudios en hombres mayores de 60 años con síntomas del tracto urinario inferior de moderados a graves analizó los efectos de los inhibidores de la fosfodiesterasa (PDE) en comparación con otros fármacos. Estos medicamentos pueden mejorar levemente los síntomas urinarios y reducir la molestia urinaria, pero también pueden causar más efectos secundarios en comparación con el placebo. Las pruebas de esta revisión encontraron que probablemente no haya diferencias entre la PDE y los bloqueadores alfa; sin embargo, cuando se usan en combinación, pueden proporcionar una mejoría mayor de los síntomas (aunque con más efectos secundarios). La PDE también mejora los síntomas cuando se usa en combinación con inhibidores de la 5-alfa reductasa.
Varios inhibidores de la fosfodiesterasa-5 son efectivos, pero pueden requerir múltiples dosis diarias para mantener un flujo de orina adecuado.[17][18] El tadalafil, un inhibidor de la fosfodiesterasa-5, fue considerado y luego rechazado por NICE en el Reino Unido para el tratamiento de los síntomas asociados a la HPB. En 2011, EE. UU. La Administración de Alimentos y Medicamentos aprobó el tadalafil para tratar los signos y síntomas de la hiperplasia prostática benigna y para el tratamiento de la HPB y la disfunción eréctil (DE), cuando estas afecciones ocurren simultáneamente.
Cirugía
Aquellas personas que no responden al tratamiento médico se les puede ofrecer tratamiento quirúrgico. La cirugía estándar para esta condición se denomina resección transuretral de próstata (RTP). Esto involucra la eliminación de (parte de) la próstata, a través de la uretra. Hay un número de nuevos métodos de reducir el tamaño de una próstata hipertrófica, de algunos de los cuales aún no se ha establecido plenamente su seguridad y sus efectos colaterales. Entre ellos están varios métodos de destruir o eliminar parte del tejido en exceso mientras se trata de evitar daños colaterales:
- Ablación de la próstata con láser de holmio (HoLAP)
- Enucleación de la próstata con láser de holmio (HoLeP)
- Vaporización fotoselectiva de la próstata (PVP): este procedimiento involucra un láser de alta potencia (GreenLight Laser) inserto dentro de la próstata. La fibra tiene un reflejo interno con un ángulo de 70° y se usa para vaporizar el tejido de la cápsula prostática. Los blancos láser apuntan a la hemoglobina como el cromóforo, y típicamente tienen una penetración de 2 mm (cuatro veces más profundo que el HoLeP).
- Terapia de ablación con agua o hidroablación (comercializada como Acquabeam): es una terapia novedosa a base de agua, que combina guía de imágenes y robótica para la eliminación de tejido prostático. Según un una revisión sistemática Cochrane,[19] el efecto de hidroablación prostática sobre los síntomas urológicos es probablemente similar al de la RTP. El efecto sobre la calidad de vida también puede ser semejante. No hay certeza sobre si los pacientes sometidos a la hidroablación prostática tienen un riesgo mayor o menor riesgo de desarrollar eventos adversos importantes. Tampoco la hay acerca de si la hidroablación prostática puede resultar en poca o ninguna diferencia en la función eréctil, pero si ofrece una pequeña mejora en la preservación de la función eyaculatoria. Los datos a largo plazo y las comparaciones con otras modalidades parecen ser fundamentales para una evaluación más exhaustiva del papel de este procedimiento para el tratamiento de la hiperplasia prostática benigna.
Procedimientos mínimamente invasivos
Existen métodos alternativos ambulatorios y con anestesia local para el tratamiento de la hiperplasia prostática benigna. Estos son importantes para los pacientes que prefieran tratamientos con menores complicaciones o con contraindicación a la anestesia general. Entre ellos se encuentran:
- Embolización de la arteria prostática: consiste en introducir un catéter por la arteria femoral hasta llegar a la arteria prostática, inyectando partículas embolizantes (microesferas, coils, alcohol polivinilico, etc.) que taponan el flujo sanguíneo a la próstata haciendo que se reduzca su tamaño.
- Termoterapia convectiva por radiofrecuencia (con vapor de agua, comercializado como Rezum): se trata de una inyección de vapor de agua en la próstata, lo que provoca la apoptosis del tejido, que es después reabsorbido de forma natural por el organismo. La intervención se lleva a cabo a través de la uretra y no requiere ingreso, por lo que puede realizarse de forma ambulatoria.[20] Una revisión sistemática del 2020 comparó el tratamiento con vapor prostático con un procedimiento simulado (placebo), donde se encontró, con certeza moderada, que este procedimiento puede mejorar la calidad de vida de los hombres con síntomas urinarios moderados.[21] Esta revisión se realizó a partir de un único ensayo con 197 hombres cuya edad promedio era de 63 años y presentaban síntomas urinarios moderadamente molestos. El tratamiento con vapor de próstata no se ha comparado con la resección transuretral de la próstata en ensayos controlados aleatorios a partir de 2020. Hay datos adicionales de estudios observacionales que mostraron resultados positivos hasta 4 años de seguimiento, especialmente aquellos relacionados con la función sexual.[22][23][24][25][26]
- Elevación de la Uretra Prostática (comercializada como UroLift): Esta intervención consiste en un sistema de un dispositivo y un implante diseñado para separar el lóbulo prostático de la uretra.[27] Según una revisión sistemática Cochrane[28] la EUP parece menos efectiva que la resección transuretral prostática (RTP) para mejorar los síntomas urológicos a corto y largo plazo, mientras que los resultados de calidad de vida serían similares. El efecto sobre la función eréctil sería similar, pero la función eyaculatoria podría ser mejor. No hay certeza acerca de los principales eventos adversos a corto plazo y no se cuenta con información a largo plazo. Tampoco hay certeza acerca de las tasas de retratamiento tanto a corto como a largo plazo.
- Dispositivo de nitinol implantable temporal (TIND e iTIND): es un dispositivo que se coloca en la uretra que, cuando se libera, se expande, remodelando la uretra y el cuello de la vejiga.[29]
- Termoterapia transuretral con microondas (TUMT) es un procedimiento ambulatorio que es menos invasivo en comparación con la cirugía e implica el uso de microondas (calor) para encoger el tejido de la próstata agrandado.[30][31]
Medicina alternativa
Si bien los remedios a base de hierbas se usan comúnmente, una revisión de 2016 encontró que las hierbas estudiadas no son mejores que el placebo.[32] En particular, varias revisiones sistemáticas encontraron que el extracto de Saw palmetto de Serenoa repens, aunque es uno de los más utilizados, no es mejor que el placebo tanto en el alivio de los síntomas como en la disminución del tamaño de la próstata.[33][34][35] Otras hierbas medicinales ineficaces incluyen beta-sitosterol[36] de Hypoxis rooperi (hierba estrella africana), pygeum (extraído de la corteza de Prunus africana),[37] semillas de calabaza (Cucurbita pepo) y raíz de ortiga (Urtica dioica). Una revisión sistemática de las hierbas medicinales chinas encontró que la medicina herbal china, ya sea como monoterapia o como terapia adyuvante con la medicina occidental, era similar al placebo o la medicina occidental en el tratamiento de la HPB. Se encontró que la medicina herbal china es superior a la medicina occidental para mejorar la calidad de vida y reducir el volumen de la próstata.[38]
Referencias
- Barry MJ, Fowler FJ Jr, O'Leary MP, et al (1992). The American Urological Association symptom index for benign prostatic hyperplasia. The Measurement Committee of the American Urological Association. J Urol 148(5): 1549-57. PMID 1279218
- Michaud JE, Billups KL, Partin AW. Testosterone and Prostate Cancer: an Evidence-Based Review of Pathogenesis and Oncologic Risk. Ther Adv Urol [Internet]. 2015;7(6):378–87. Available from: http://dx.doi.org/10.1177/1756287215597633
- Gass, R. (2002). «Benign Prostatic Hyperplasia: the Opposite Effects of Alcohol and Coffee Intake». BJU International (Wiley-Blackwell Publishing) 90 (7): 649-654. ISSN 1464-410X. doi:10.1046/j.1464-410X.2002.03001.x.
- Silva, Valter; Grande, Antonio José; Peccin, Maria S (6 de abril de 2019). «Physical Activity for Lower Urinary Tract Symptoms Secondary to Benign Prostatic Obstruction». En Cochrane Urology Group, ed. Cochrane Database of Systematic Reviews (en inglés). PMID 30953341. doi:10.1002/14651858.CD012044.pub2. Consultado el 14 de abril de 2021.
- Kaplan SA, McConnell JD, Roehrborn CG, et al (2006). Combination therapy with doxazosin and finasteride for benign prostatic hyperplasia in patients with lower urinary tract symptoms and a baseline total prostate volume of 25 ml or greater. J Urol 175(1): 217-20. PMID 16406915.
- Roehrborn, Claus G.; Nuckolls, James G.; Wei, John T.; Steers, William; the BPH Registry and Patient Survey Steering Committee (2007-10-XX). «The Benign Prostatic Hyperplasia Registry and Patient Survey: study design, methods and patient baseline characteristics». BJU International (en inglés) 100 (4): 813-819. ISSN 1464-4096. doi:10.1111/j.1464-410X.2007.07061.x. Consultado el 14 de abril de 2021.
- Therapeutic Treatment for Benign Prostatic Hyperplasia. CRC Press. 16 de junio de 2005. pp. 19-48. ISBN 978-0-429-21688-6. Consultado el 14 de abril de 2021.
- Hutchison, Annie; Farmer, Richard; Verhamme, Katia; Berges, Richard; Navarrete, Remigio Vela (2007-01-XX). «The Efficacy of Drugs for the Treatment of LUTS/BPH, A Study in 6 European Countries». European Urology (en inglés) 51 (1): 207-216. doi:10.1016/j.eururo.2006.06.012. Consultado el 14 de abril de 2021.
- MacDonald, Roderick; Wilt, Timothy J. (2005-10-XX). «Alfuzosin for treatment of lower urinary tract symptoms compatible with benign prostatic hyperplasia: A systematic review of efficacy and adverse effects». Urology (en inglés) 66 (4): 780-788. doi:10.1016/j.urology.2005.05.001. Consultado el 14 de abril de 2021.
- Roehrborn, Claus G (2001-12-XX). «Efficacy and safety of once-daily alfuzosin in the treatment of lower urinary tract symptoms and clinical benign prostatic hyperplasia: a randomized, placebo-controlled trial». Urology (en inglés) 58 (6): 953-959. doi:10.1016/S0090-4295(01)01448-0. Consultado el 14 de abril de 2021.
- MacDonald, Roderick; Wilt, Timothy J.; Howe, R. William (2004-12-XX). «Doxazosin for treating lower urinary tract symptoms compatible with benign prostatic obstruction: a systematic review of efficacy and adverse effects». BJU International (en inglés) 94 (9): 1263-1270. ISSN 1464-4096. doi:10.1111/j.1464-410X.2004.05154.x. Consultado el 14 de abril de 2021.
- Hwang, Eu Chang; Gandhi, Shreyas; Jung, Jae Hung; Imamura, Mari; Kim, Myung Ha; Pang, Ran; Dahm, Philipp (11 de octubre de 2018). «Naftopidil for the treatment of lower urinary tract symptoms compatible with benign prostatic hyperplasia». En Cochrane Urology Group, ed. Cochrane Database of Systematic Reviews (en inglés). PMC 6516835. PMID 30306544. doi:10.1002/14651858.CD007360.pub3. Consultado el 14 de abril de 2021.
- Wilt, Timothy; MacDonald, Roderick; Rutks, Indy (21 de octubre de 2002). The Cochrane Collaboration, ed. Cochrane Database of Systematic Reviews (en inglés). John Wiley & Sons, Ltd. pp. CD002081. doi:10.1002/14651858.cd002081. Consultado el 14 de abril de 2021.
- Djavan, Bob; Marberger, Michael (1999). «A Meta-Analysis on the Efficacy and Tolerability of α1-Adrenoceptor Antagonists in Patients with Lower Urinary Tract Symptoms Suggestive of Benign Prostatic Obstruction». European Urology 36 (1): 1-13. doi:10.1159/000019919. Consultado el 14 de abril de 2021.
- Santillo, Vincent M; Lowe, Franklin C (2006). «Treatment of Benign Prostatic Hyperplasia in Patients with Cardiovascular Disease:». Drugs & Aging (en inglés) 23 (10): 795-805. ISSN 1170-229X. doi:10.2165/00002512-200623100-00003. Consultado el 14 de abril de 2021.
- McVary KT, Monnig W, Camps JL Jr, et al (2007). Sildenafil citrate improves erectile function and urinary symptoms in men with erectile dysfunction and lower urinary tract symptoms associated with benign prostatic hyperplasia: a randomized, double-blind trial. J Urol 177(3) :1071-7. PMID 17296414
- Wang, Yilin; Bao, Yiping; Liu, Jie; Duan, Lijun; Cui, Yuanshan (2018-01-XX). «Tadalafil 5 mg Once Daily Improves Lower Urinary Tract Symptoms and Erectile Dysfunction: A Systematic Review and Meta-analysis: Tadalafil for LUTS and ED». LUTS: Lower Urinary Tract Symptoms (en inglés) 10 (1): 84-92. doi:10.1111/luts.12144. Consultado el 14 de abril de 2021.
- Pattanaik, Smita; Mavuduru, Ravimohan S; Panda, Arabind; Mathew, Joseph L; Agarwal, Mayank M; Hwang, Eu Chang; Lyon, Jennifer A; Singh, Shrawan K et al. (16 de noviembre de 2018). «Phosphodiesterase inhibitors for lower urinary tract symptoms consistent with benign prostatic hyperplasia». En Cochrane Urology Group, ed. Cochrane Database of Systematic Reviews (en inglés). PMID 30480763. doi:10.1002/14651858.CD010060.pub2. Consultado el 14 de abril de 2021.
- Hwang, Eu Chang; Jung, Jae Hung; Borofsky, Michael; Kim, Myung Ha; Dahm, Philipp (13 de febrero de 2019). «Aquablation of the prostate for the treatment of lower urinary tract symptoms in men with benign prostatic hyperplasia». En Cochrane Urology Group, ed. Cochrane Database of Systematic Reviews (en inglés). PMID 30759311. doi:10.1002/14651858.CD013143.pub2. Consultado el 6 de noviembre de 2019.
- Mcvary, KT (19 de marzo de 2017). «Convective Thermal Therapy: Durable 2-Year Results of Randomized Controlled and Prospective Crossover Studies for Treatment of Lower Urinary Tract Symptoms Due to Benign Prostatic Hyperplasia.». Elsevier Inc. Consultado el 29 de marzo de 2019.
- Kang, Tae Wook; Jung, Jae Hung; Hwang, Eu Chang; Borofsky, Michael; Kim, Myung Ha; Dahm, Philipp (25 de marzo de 2020). «Convective radiofrequency water vapour thermal therapy for lower urinary tract symptoms in men with benign prostatic hyperplasia». En Cochrane Urology Group, ed. Cochrane Database of Systematic Reviews (en inglés). PMID 32212174. doi:10.1002/14651858.CD013251.pub2. Consultado el 15 de abril de 2021.
- McVary, Kevin T.; Rogers, Tyson; Mahon, Joseph; Gupta, Nikhil K. (1 de diciembre de 2018). «Is Sexual Function Better Preserved After Water Vapor Thermal Therapy or Medical Therapy for Lower Urinary Tract Symptoms due to Benign Prostatic Hyperplasia?». The Journal of Sexual Medicine (en inglés) 15 (12): 1728-1738. ISSN 1743-6095. PMID 30446471. doi:10.1016/j.jsxm.2018.10.006. Consultado el 15 de abril de 2021.
- Westwood, Jennifer; Geraghty, Robert; Jones, Patrick; Rai, Bhavan P.; Somani, Bhaskar K. (2018-11-XX). «Rezum: a new transurethral water vapour therapy for benign prostatic hyperplasia». Therapeutic Advances in Urology (en inglés) 10 (11): 327-333. ISSN 1756-2872. PMC 6180381. PMID 30344644. doi:10.1177/1756287218793084. Consultado el 15 de abril de 2021.
- Leong, Joon Yau; Patel, Amir S.; Ramasamy, Ranjith (2019-09-XX). «Minimizing Sexual Dysfunction in BPH Surgery». Current Sexual Health Reports (en inglés) 11 (3): 190-200. ISSN 1548-3584. PMC 6714584. PMID 31467497. doi:10.1007/s11930-019-00210-1. Consultado el 15 de abril de 2021.
- Doppalapudi, Sai K.; Gupta, Nikhil (2021-01-XX). «What Is New with Rezūm Water Vapor Thermal Therapy for LUTS/BPH?». Current Urology Reports (en inglés) 22 (1): 4. ISSN 1527-2737. doi:10.1007/s11934-020-01018-6. Consultado el 15 de abril de 2021.
- Miller, Larry E.; Chughtai, Bilal; McVary, Kevin; Gonzalez, Ricardo R.; Rojanasarot, Sirikan; DeRouen, Kyle; Bhattacharyya, Samir (24 de julio de 2020). «Water vapor thermal therapy for lower urinary tract symptoms secondary to benign prostatic hyperplasia: Systematic review and meta-analysis». Medicine (en inglés) 99 (30): e21365. ISSN 0025-7974. PMC 7387023. PMID 32791742. doi:10.1097/MD.0000000000021365. Consultado el 15 de abril de 2021.
- McNicholas, Thomas Anthony (2016). «Benign prostatic hyperplasia and new treatment options - a critical appraisal of the UroLift system». Medical Devices (Auckland, N.Z.) 9: 115-123. ISSN 1179-1470. PMC 4876946. PMID 27274321. doi:10.2147/MDER.S60780. Consultado el 27 de febrero de 2021.
- Jung, Jae Hung; Reddy, Balaji; McCutcheon, Karen Ann; Borofsky, Michael; Narayan, Vikram; Kim, Myung Ha; Dahm, Philipp (25 de mayo de 2019). «Prostatic urethral lift for the treatment of lower urinary tract symptoms in men with benign prostatic hyperplasia». En Cochrane Urology Group, ed. Cochrane Database of Systematic Reviews (en inglés). PMC 6535104. PMID 31128077. doi:10.1002/14651858.CD012832.pub2. Consultado el 6 de noviembre de 2019.
- Porpiglia, Francesco; Fiori, Cristian; Bertolo, Riccardo; Garrou, Diletta; Cattaneo, Giovanni; Amparore, Daniele (2015-08). «Temporary implantable nitinol device (TIND): a novel, minimally invasive treatment for relief of lower urinary tract symptoms (LUTS) related to benign prostatic hyperplasia (BPH): feasibility, safety and functional results at 1 year of follow-up». BJU international 116 (2): 278-287. ISSN 1464-410X. PMID 25382816. doi:10.1111/bju.12982. Consultado el 27 de febrero de 2021.
- Hoffman, Richard M.; Monga, Manoj; Elliott, Sean P.; Macdonald, Roderick; Langsjoen, Jens; Tacklind, James; Wilt, Timothy J. (12 de septiembre de 2012). «Microwave thermotherapy for benign prostatic hyperplasia». The Cochrane Database of Systematic Reviews (9): CD004135. ISSN 1469-493X. PMID 22972068. doi:10.1002/14651858.CD004135.pub3. Consultado el 27 de febrero de 2021.
- Hoffman, Richard M; Monga, Manoj; Elliott, Sean P; MacDonald, Roderick; Langsjoen, Jens; Tacklind, James; Wilt, Timothy J (12 de septiembre de 2012). «Microwave thermotherapy for benign prostatic hyperplasia». En Cochrane Urology Group, ed. Cochrane Database of Systematic Reviews (en inglés). doi:10.1002/14651858.CD004135.pub3. Consultado el 14 de abril de 2021.
- Keehn, Aryeh; Taylor, Jacob; Lowe, Franklin C. (2016-07-XX). «Phytotherapy for Benign Prostatic Hyperplasia». Current Urology Reports (en inglés) 17 (7): 53. ISSN 1527-2737. doi:10.1007/s11934-016-0609-z. Consultado el 14 de abril de 2021.
- Bent, Stephen; Kane, Christopher; Shinohara, Katsuto; Neuhaus, John; Hudes, Esther S.; Goldberg, Harley; Avins, Andrew L. (9 de febrero de 2006). «Saw Palmetto for Benign Prostatic Hyperplasia». New England Journal of Medicine (en inglés) 354 (6): 557-566. ISSN 0028-4793. doi:10.1056/NEJMoa053085. Consultado el 14 de abril de 2021.
- Dedhia, Raj C.; McVary, Kevin T. (2008-06-XX). «Phytotherapy for Lower Urinary Tract Symptoms Secondary to Benign Prostatic Hyperplasia». Journal of Urology (en inglés) 179 (6): 2119-2125. ISSN 0022-5347. doi:10.1016/j.juro.2008.01.094. Consultado el 14 de abril de 2021.
- Tacklind, James; MacDonald, Roderick; Rutks, Indy; Stanke, Judith U; Wilt, Timothy J (12 de diciembre de 2012). «Serenoa repens for benign prostatic hyperplasia». En Cochrane Urology Group, ed. Cochrane Database of Systematic Reviews (en inglés). PMC 7084061. PMID 23235581. doi:10.1002/14651858.CD001423.pub3. Consultado el 14 de abril de 2021.
- Wilt, Timothy J; Ishani, Areef; MacDonald, Roderick; Stark, Gerold; Mulrow, Cynthia D; Lau, Joseph (26 de julio de 1999). «Beta-sitosterols for benign prostatic hyperplasia». En Cochrane Urology Group, ed. Cochrane Database of Systematic Reviews (en inglés). doi:10.1002/14651858.CD001043. Consultado el 14 de abril de 2021.
- Wilt, Timothy J; Ishani, Areef (26 de enero de 1998). «Pygeum africanum for benign prostatic hyperplasia». En Cochrane Urology Group, ed. Cochrane Database of Systematic Reviews (en inglés). PMC 7032619. PMID 11869585. doi:10.1002/14651858.CD001044. Consultado el 14 de abril de 2021.
- Ma, Chun Ho; Lin, Wai Ling; Lui, Sing Leung; Cai, Xun-Yuan; Wong, Vivian Taam; Ziea, Eric; Zhang, Zhang-Jin (2013-07-XX). «Efficacy and safety of Chinese herbal medicine for benign prostatic hyperplasia: systematic review of randomized controlled trials». Asian Journal of Andrology 15 (4): 471-482. ISSN 1008-682X. PMC 3739225. PMID 23728585. doi:10.1038/aja.2012.173. Consultado el 14 de abril de 2021.
Enlaces externos
 Wikimedia Commons alberga una categoría multimedia sobre Hiperplasia benigna de próstata.
Wikimedia Commons alberga una categoría multimedia sobre Hiperplasia benigna de próstata.- Agrandamiento de la próstata, artículo en la enciclopedia MedlinePlus.
- Flashes históricos sobre el prostatismo y la retentión de orina
- Plotyan G. El papel moderado de la duración de la actividad física en el tratamiento de la hiperplasia prostática benigna
- Urólogo Mario Domínguez Video con soluciones o tratamientos que existen para la hiperplasia benigna de próstata