Iluro (química)
Un iluro es una molécula dipolar eléctricamente neutra que contiene un átomo con una carga formal negativa (comúnmente un carbanión), unido a otro heteroátomo con una carga formal positiva (por lo general un nitrógeno, fósforo o azufre), y en la cual ambos átomos poseen un octeto completo de electrones. Los iliuros son también compuestos dipolares de tipo 1,2.[1] Aparecen con frecuencia en química orgánica como reactivos, o compuestos intermediarios.[2]
El nombre de tipo de molécula "iluro" no debe ser confundido con el sufijo "-iliuro".
Estructuras de resonancia
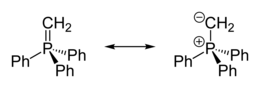
Muchos iluros, pueden ser descritos por un enlace múltiple formando una estructura de resonancia, conocida como estructura ileno:
La verdadera distribución de electrones en la molécula y su importancia relativa entre la forma iluro e ileno depende del núcleo "onio" y del patrón de sustituyentes (la identidad de los grupos sustituyentes R).
Iluros de fosfonio
Los iluros de fosfonio se utilizan en la reacción de Wittig, un método para convertir cetonas y en especial aldehídos en alquenos. La carga positiva en esta reacción, es soportada por un átomo de fósforo con tres sustituyentes fenilo y unido a un carbanion. Los iluros pueden ser estabilizados o no estabilizados. Un iluro de fosfonio puede ser preparado in situ sin mayores problemas. Típicamentes se deja reaccionar trifenilfosfina con un haluro de alquilo en un mecanismo análogo a una reacción SN2. Esta cuaternización forma una sal de alquiltrifenilfosfonio, la cual puede ser aislada o tratada in situ con una base fuerte (en este caso butil litio, para formar el iluro.
Debido al mecanismo SN2, un haluro de alquilo menos impedido estéricamente reacciona en forma más favorable con trifenilfosfina que un haluro de alquilo con impedimento estérico más significativo (: tal como por ejemplo el bromuro de terc-butil). Debido a esto, típicamente existe una única ruta sintética favorable, lo que conduce a que el producto de esta ruta sea el que se forma mayormente.
Otros tipos de iluros
Basados en el azufre
Otros iluros comunes son los iluros de sulfonio y los iluros de sulfoxonio, por ejemplo el reactivo de Corey-Chaykovsky que se utiliza en la síntesis de epóxidos o en el rearreglo de Stevens.
Basados en el oxígeno
Los iluros de carbonilo (RR'C=O+
C−
RR') pueden formarse por apertura del anillo de epóxidos. Los iluros de oxonio (RR'-O+
-C−
R'R) se preparan por la reacción de éteres con compuestos diazo.
Basados en el nitrógeno
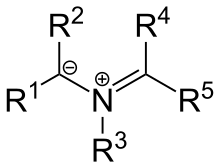
También existen ciertos iluros basados en el nitrógeno como por ejemplo los iluros de azometina, los cuales poseen la estructura general:
Este compuesto puede ser visto como un catión iminio ubicado al lado de un carbanion. Los sustituyentes R1, R2 son grupos aceptores de electrones. Estos iluros se pueden sintetizar por la condensación de un α-aminoácido con un aldehído o por la apertura termal del anillo en ciertas aziridinas N-sustituidas. Los carbenos estables también poseen un contribuyente por resonancia ilúrico, por ejemplo:
Otros
Los iluros de halonio pueden prepararse a partir de alil haluros y carbenoides metálicos. Luego de un rearreglo [2,3], se obtiene un homoalilhaluro.
La forma activa del reactivo de Tebbe se considera con frecuencia un iluro de titanio. Al igual que el reactivo de Wittig, es capaz de reemplazar el átomo de oxígeno en un grupo carbonilo por un grupo metileno. Comparado con el reactivo de Wittig, es más tolerante en cuanto a grupos funcionales.
Reacciones de los iluros
Una reacción muy importante de los iluros es, por supuesto, la reacción de Wittig para el fósforo, pero hay muchas más.
Cicloadiciones dipolares
Algunos iluros son dipolos 1,3 y pueden interactuar en cicloadiciones dipolares 1,3. Por ejemplo, un iluro de azometino es un dipolo en la reacción de Prato con los fullerenos.
Deshidroacoplamiento con silanos
En presencia del catalizador homoléptico del grupo 3 Y[N(SiMe
3)
2]
3, el metiluro de trifenilfosfonio puede ser acoplado con fenilsilano.[3] Esta reacción produce gas H
2 como subproducto, y produce un iluro silil estabilizado.
Rearreglos sigmatrópicos
Muchos iluros reaccionan en reacciones sigmatrópicas.[4] El rearreglo de Sommelet-Hauser es un ejemplo de una reacción [2,3]-sigmatrópica. El rearreglo de Stevens es un rearreglo [1,2].
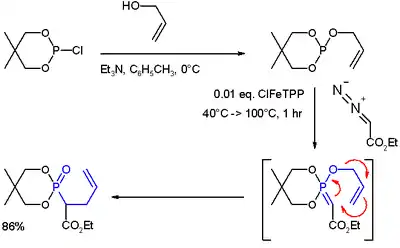
Se ha observado una reacción sigmatrópica [3,3] en ciertos iluros de fosfonio[5][6]
Rearreglos alílicos
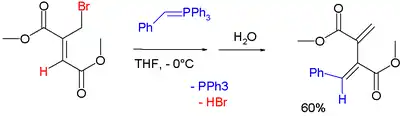
Los reactivos de Wittig funcionan como nucleófilos en las sustituciones SN2':[7]
La reacción de adición inicial es seguida por una reacción de eliminación.
Véase también
- Dipolo 1,3
- Zwitterion
- Betaina
Referencias
- Unión Internacional de Química Pura y Aplicada. «ylides». Compendium of Chemical Terminology. Versión en línea (en inglés).
- McMurry, John (2008). Organic Chemistry, 7th Ed. Thomson Brooks/Cole. pp. 720-722. ISBN 978-0-495-11258-7.
- A. E. Nako, A. J. P. White, M. R. Crimmin, Chem. Sci., 2013,4, 691-695, DOI: 10.1039/C2SC21123H
- Sigmatropic rearrangements of ‘onium’ ylids J. B. Sweeney Chem. Soc. Rev., 2009, 38, 1027–1038 doi 10.1039/b604828p
- Ferguson, Marcelle L.; Groendyke, Todd M.; Mapp, Anna K. (2006). «[3,3]-Rearrangements of Phosphonium Ylides». J. Am. Chem. Soc. 128 (14): 4576-4577. PMID 16594686. doi:10.1021/ja058746q.
|autor1=y|last=redundantes (ayuda) - (i) Reaction of allyl alcohol with 2-chloro-5,5-dimethyl-1,3,2-dioxaphosphorinane forms a phosphite ester. (ii) Metal carbene addition (from ethyl diazoacetate and ClFeTPP) forms an ylide. (iii) A rearrangement reaction (in blue) yields a phosphonate.
- Ramesh M. Patel and Narshinha P. Argade (2007). «Facile SN2' Coupling Reactions of Wittig Reagents with Dimethyl Bromomethylfumarate: Synthesis of Enes, Dienes, and Related Natural Products». J. Org. Chem. 72 (13): 4900-4904. PMID 17539690. doi:10.1021/jo070728z.