Inmunidad de grupo
La inmunidad de grupo, también llamada inmunidad colectiva o inmunidad de rebaño, es un fenómeno bioestadístico que se observa en una población cuando parte de ella se ha hecho inmune a una enfermedad por contagio previo o porque ha sido vacunada y se interrumpe la cadena epidemiológica entre sus individuos, provocando una forma indirecta de protección contra una enfermedad previniendo que individuos no inmunizados se contagien.[1] En las enfermedades que se transmiten de individuo a individuo es más difícil mantener una cadena de infección cuando una gran parte de la población es inmune. Cuanta mayor es la proporción de individuos inmunes, menor es la probabilidad de que un individuo susceptible entre en contacto con un individuo infectado.[2]
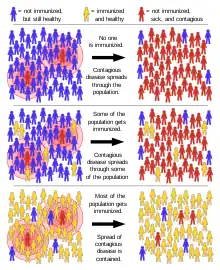
Ocurre en medida en que el porcentaje de personas inmunes va en aumento, llega un punto en que las probabilidades de propagación de la enfermedad son tan bajas, que se considera que esa población ha adquirido «inmunidad de rebaño». Los individuos vacunados o infectados previamente actúan como una especie de cortafuegos para la diseminación de la enfermedad, ralentizando o evitando la transmisión de la enfermedad a otros individuos.[3] Los individuos vulnerables quedan protegidos indirectamente por los individuos inmunizados, ya que estos últimos no contraerán la enfermedad de individuos infectados ni la transmitirán a los susceptibles.[2] De esta manera, se puede asumir una política de salud pública de inmunidad de grupo para reducir la difusión de una enfermedad y proporcionar un nivel de protección a un subgrupo vulnerable o no vacunado.
Ya que solo se puede dejar a una pequeña parte de la población sin vacunar para que este método sea efectivo se considera apropiado dejar sin vacunar a los que no pueden recibir vacunas, bien por una condición médica como una inmunodeficiencia o para los receptores de trasplantes.
Historia
El término "inmunidad colectiva" se acuñó en 1923. La inmunidad colectiva se reconoció por primera vez como un fenómeno natural en la década de 1930 cuando AW Hedrich publicó una investigación sobre la epidemiología del sarampión en Baltimore , y se dio cuenta de que después de muchos niños se habían vuelto inmunes al sarampión, el número de nuevas infecciones disminuyó temporalmente, incluso entre los niños susceptibles. A pesar de este conocimiento, los esfuerzos para controlar y eliminar el sarampión no tuvieron éxito hasta que comenzó la vacunación masiva con la vacuna contra el sarampión en la década de 1960. Posteriormente, la vacunación masiva, las discusiones sobre la erradicación de enfermedades y los análisis de costo-beneficio de la vacunación llevaron a un uso más generalizado del término inmunidad colectiva . En la década de 1970, se desarrolló el teorema utilizado para calcular el umbral de inmunidad colectiva de una enfermedad. Durante la campaña de erradicación de la viruela en las décadas de 1960 y 1970, la práctica de la vacunación en anillo , a la que la inmunidad colectiva es integral, comenzó como una forma de inmunizar a todas las personas en un «círculo» alrededor de un individuo infectado para evitar que los brotes se propaguen.[4][5]
Desde la adopción de la vacunación masiva y en anillo, han surgido complejidades y desafíos para la inmunidad colectiva. Según muchos epidemiólogos y la Organización Mundial de la Salud (OMS), el porcentaje apropiado para lograr que esto suceda es del 70%, modelado de la propagación de enfermedades infecciosas originalmente hizo una serie de suposiciones, a saber, que poblaciones enteras son susceptibles y están bien mezcladas, lo que no es el caso en la realidad, por lo que se han desarrollado ecuaciones más precisas. En las últimas décadas, se ha reconocido que la cepa dominante de un microorganismo en circulación puede cambiar debido a la inmunidad de grupo, ya sea porque la inmunidad de grupo actúa como una presión evolutiva o porque la inmunidad de grupo contra una cepa permitió otra cepa ya existente. para difundir. Los temores y controversias emergentes o en curso sobre la vacunación han reducido o eliminado la inmunidad colectiva en ciertas comunidades, permitiendo que las enfermedades prevenibles persistan o regresen a estas comunidades.[6][7]
Efectos
Protección de quienes no tienen inmunidad
Algunas personas no pueden desarrollar inmunidad después de la vacunación o, por razones médicas, no pueden vacunarse. Los bebés recién nacidos son demasiado pequeños para recibir muchas vacunas, ya sea por razones de seguridad o porque la inmunidad pasiva hace que la vacuna sea ineficaz. Las personas inmunodeficientes debido al VIH/sida, linfoma, leucemia, cáncer de médula ósea, insuficiencia del bazo, quimioterapia o radioterapia pueden haber perdido cualquier inmunidad que tenían anteriormente y es posible que las vacunas no les sean de utilidad debido a su inmunodeficiencia.
Es posible que una parte de los vacunados no desarrolle inmunidad a largo plazo. contraindicaciones de la vacuna pueden impedir que determinadas personas sean vacunadas. Además de no ser inmunes, los individuos de uno de estos grupos pueden tener un mayor riesgo de desarrollar complicaciones por infección debido a su estado médico, pero aún pueden estar protegidos si un porcentaje suficientemente grande de la población es inmune.[8][9]
Los altos niveles de inmunidad en un grupo de edad pueden crear inmunidad colectiva para otros grupos de edad. vacunación de los adultos contra la tos ferina reduce la incidencia de la tos ferina en bebés demasiado pequeños para ser vacunados, quienes tienen el mayor riesgo de sufrir complicaciones por la enfermedad. Esto es especialmente importante para los familiares cercanos, que representan la mayoría de las transmisiones a los bebés pequeños. De la misma manera, los niños que reciben vacunas contra el neumococo reducen la incidencia de la enfermedad neumocócica entre los hermanos menores no vacunados. vacunación de los niños contra el neumococo y el rotavirus ha tenido el efecto de reducir el neumococo , yHospitalizaciones atribuibles a rotavirus para niños mayores y adultos, que normalmente no reciben estas vacunas. influenza (gripe) es más grave en los ancianos que en los grupos de edad más jóvenes, pero las vacunas contra la influenza carecen de efectividad en este grupo demográfico debido a la disminución del sistema inmunológico con la edad. Sin embargo, se ha demostrado que la priorización de los niños en edad escolar para la inmunización contra la influenza estacional, que es más eficaz que vacunar a los ancianos, crea un cierto grado de protección para los ancianos.[10][11][12]
Para las infecciones de transmisión sexual (ITS), los altos niveles de inmunidad en un sexo inducen la inmunidad colectiva para ambos sexos. vacunas contra las ITS dirigidas a un sexo dan como resultado una disminución significativa de las ITS en ambos sexos si la absorción de la vacuna en el sexo objetivo es alta. Sin embargo, la inmunidad colectiva de la vacunación femenina no se extiende a los varones homosexuales. Si la aceptación de la vacuna entre el sexo objetivo es baja, es posible que el otro sexo deba inmunizarse para que el sexo objetivo pueda estar suficientemente protegido. Los comportamientos de alto riesgo dificultan la eliminación de las ITS, ya que aunque la mayoría de las infecciones ocurren entre personas con riesgo moderado, la mayoría de las transmisiones ocurren debido a individuos que se involucran en comportamientos de alto riesgo. Por estas razones, en determinadas poblaciones puede ser necesario inmunizar a personas de alto riesgo o individuos de ambos sexos para establecer la inmunidad colectiva.[13]
Presión evolutiva y reemplazo de serotipos
La inmunidad colectiva actúa en sí misma como una presión evolutiva sobre los patógenos, influyendo en la evolución viral al estimular la producción de nuevas cepas, denominadas mutantes de escape, que pueden evadir la inmunidad colectiva e infectar a individuos previamente inmunes. La evolución de nuevas cepas se conoce como reemplazo de serotipo , o cambio de serotipo, ya que la prevalencia de un serotipo específico disminuye debido a los altos niveles de inmunidad, lo que permite que otros serotipos lo reemplacen.[14][15]
A nivel molecular, los virus escapan de la inmunidad colectiva a través de la deriva antigénica , que es cuando las mutaciones se acumulan en la porción del genoma viral que codifica el antígeno de superficie del virus , típicamente una proteína de la cápside del virus , produciendo un cambio en el epítopo viral . Alternativamente, el reordenamiento de segmentos separados del genoma viral, o el cambio antigénico , que es más común cuando hay más cepas en circulación, también puede producir nuevos serotipos . Cuando ocurre cualquiera de estos, las células T de memoria ya no reconocen el virus, por lo que las personas no son inmunes a la cepa circulante dominante. Tanto para la influenza como para el norovirus , las epidemias inducen temporalmente la inmunidad colectiva hasta que surge una nueva cepa dominante, lo que provoca sucesivas oleadas de epidemias. Dado que esta evolución representa un desafío para la inmunidad colectiva, se están desarrollando anticuerpos ampliamente neutralizantes y vacunas «universales» que pueden brindar protección más allá de un serotipo específico.[16][17]
Las vacunas iniciales contra Streptococcus pneumoniae redujeron significativamente el transporte nasofaríngeo de serotipos vacunales (VT), incluidos los tipos resistentes a los antibióticos , sólo para compensarse por completo con un mayor transporte de serotipos no vacunales (NVT). Sin embargo, esto no resultó en un aumento proporcional en la incidencia de la enfermedad, ya que los NVT eran menos invasivos que los VT. Desde entonces, se han introducido vacunas antineumocócicas que brindan protección contra los serotipos emergentes y han logrado contrarrestar su aparición. La posibilidad de cambios futuros permanece, por lo que otras estrategias para abordar esto incluyen la expansión de la cobertura de TV y el desarrollo de vacunas que usan células enteras muertas , que tienen más antígenos de superficie, o proteínas presentes en múltiples serotipos.
Erradicación de enfermedades

Si se ha establecido y mantenido la inmunidad colectiva en una población durante un tiempo suficiente, la enfermedad se elimina inevitablemente: no se producen más transmisiones endémicas. Si la eliminación se logra en todo el mundo y el número de casos se reduce permanentemente a cero, entonces una enfermedad puede declararse erradicada. Por tanto, la erradicación puede considerarse el efecto final o el resultado final de las iniciativas de salud pública para controlar la propagación de enfermedades infecciosas.[18][19]
Los beneficios de la erradicación incluyen poner fin a toda la morbilidad y mortalidad causadas por la enfermedad, ahorros financieros para las personas, los proveedores de atención médica y los gobiernos, y permitir que los recursos utilizados para controlar la enfermedad se utilicen en otros lugares. Hasta la fecha, se han erradicado dos enfermedades mediante la inmunidad colectiva y la vacunación: la peste bovina y la viruela . Actualmente se están realizando esfuerzos de erradicación de la poliomielitis que dependen de la inmunidad colectiva , aunque los disturbios civiles y la desconfianza hacia la medicina moderna lo han dificultado. Vacunación obligatoria puede ser beneficioso para los esfuerzos de erradicación si no hay suficientes personas que decidan vacunarse.[20][21]
Véase también
Referencias
- John TJ, Samuel R (2000). «Herd immunity and herd effect: new insights and definitions». Eur. J. Epidemiol. (en inglés) 16 (7): 601-6. PMID 11078115. doi:10.1023/A:1007626510002.
- Centros para el Control y Prevención de Enfermedades y Organización Mundial de la Salud. «History and Epidemiology of Global Smallpox Eradication» (PDF). From the training course titled "Smallpox: Disease, Prevention, and Intervention". (en inglés). pp. 16-17. Archivado desde el original el 15 de julio de 2007.
- Fine P (1993). «Herd immunity: history, theory, practice». Epidemiol Rev (en inglés) 15 (2): 265-302. PMID 8174658.
- Topley, W. W. C.; Wilson, G. S. (1923-05). «The Spread of Bacterial Infection. The Problem of Herd-Immunity». The Journal of Hygiene 21 (3): 243-249. ISSN 0022-1724. PMC 2167341. PMID 20474777. Consultado el 2 de abril de 2021.
- Hedrich, AW (1933). Estimaciones mensuales de la población infantil susceptible al sarampión, 1900–1931, Baltimore, Md. American Journal of Epidemiology , 17 (3), 613–636.
- Strassburg, Marc A. (1 de mayo de 1982). «The global eradication of smallpox». American Journal of Infection Control (en inglés) 10 (2): 53-59. ISSN 0196-6553. PMID 7044193. doi:10.1016/0196-6553(82)90003-7. Consultado el 2 de abril de 2021.
- Rashid, Harunor; Khandaker, Gulam; Booy, Robert (2012-06). «Vaccination and herd immunity». Current Opinion in Infectious Diseases (en inglés estadounidense) 25 (3): 243-249. ISSN 0951-7375. doi:10.1097/qco.0b013e328352f727. Consultado el 2 de abril de 2021.
- Munoz Flor M. (1 de agosto de 2013). «Maternal Immunization: An Update for Pediatricians». Pediatric Annals 42 (8): e163-e168. doi:10.3928/00904481-20130723-09. Consultado el 2 de abril de 2021.
- National Center for Immunization and Respiratory Diseases (28 de enero de 2011). «General recommendations on immunization --- recommendations of the Advisory Committee on Immunization Practices (ACIP)». MMWR. Recommendations and reports: Morbidity and mortality weekly report. Recommendations and reports 60 (2): 1-64. ISSN 1545-8601. PMID 21293327. Consultado el 2 de abril de 2021.
- Esposito, S.; Bosis, S.; Morlacchi, L.; Baggi, E.; Sabatini, C.; Principi, N. (1 de octubre de 2012). «Can infants be protected by means of maternal vaccination?». Clinical Microbiology and Infection (en inglés) 18: 85-92. ISSN 1198-743X. PMID 22862749. doi:10.1111/j.1469-0691.2012.03936.x. Consultado el 2 de abril de 2021.
- Wolfe, Robert M. (1 de julio de 2012). «Update on Adult Immunizations». The Journal of the American Board of Family Medicine (en inglés) 25 (4): 496-510. ISSN 1557-2625. PMID 22773718. doi:10.3122/jabfm.2012.04.100274. Consultado el 2 de abril de 2021.
- Rakel, David; Rakel, Robert E. (2 de febrero de 2015). Textbook of Family Medicine E-Book (en inglés). Elsevier Health Sciences. ISBN 978-0-323-31308-7. Consultado el 2 de abril de 2021.
- Tulchinsky, Theodore H.; Varavikova, Elena A. (26 de marzo de 2014). The New Public Health (en inglés). Academic Press. ISBN 978-0-12-415767-5. Consultado el 2 de abril de 2021.
- Rodpothong, Patsarin; Auewarakul, Prasert (12 de octubre de 2012). «Viral evolution and transmission effectiveness». World Journal of Virology 1 (5): 131-134. ISSN 2220-3249. PMC 3782273. PMID 24175217. doi:10.5501/wjv.v1.i5.131. Consultado el 2 de abril de 2021.
- Corti, Davide; Lanzavecchia, Antonio (21 de marzo de 2013). «Broadly Neutralizing Antiviral Antibodies». Annual Review of Immunology 31 (1): 705-742. ISSN 0732-0582. doi:10.1146/annurev-immunol-032712-095916. Consultado el 2 de abril de 2021.
- Pleschka, Stephan (2013). Richt, Jürgen A., ed. Swine Influenza. Current Topics in Microbiology and Immunology (en inglés). Springer. pp. 1-20. ISBN 978-3-642-36871-4. doi:10.1007/82_2012_272. Consultado el 2 de abril de 2021.
- Lynch, Joseph P; Zhanel, George G (2010-04). «Streptococcus pneumoniae: epidemiology and risk factors, evolution of antimicrobial resistance, and impact of vaccines». Current Opinion in Pulmonary Medicine (en inglés estadounidense): 1. ISSN 1070-5287. doi:10.1097/mcp.0b013e3283385653. Consultado el 2 de abril de 2021.
- Cliff, Andrew; Smallman-Raynor, Matthew (11 de abril de 2013). Oxford Textbook of Infectious Disease Control: A Geographical Analysis from Medieval Quarantine to Global Eradication (en inglés). OUP Oxford. ISBN 978-0-19-959661-4. Consultado el 2 de abril de 2021.
- Somerville, Margaret; Kumaran, K.; Anderson, Rob (19 de enero de 2012). Public Health and Epidemiology at a Glance (en inglés). John Wiley & Sons. ISBN 978-1-118-30864-6. Consultado el 2 de abril de 2021.
- NJEUMI, F.; TAYLOR, W.D.; DIALLO, A.; MIYAGISHIMA, K.; PASTORET, P-P; VALLAT, B.; TRAORE, M. (1 de diciembre de 2012). «The long journey: a brief review of the eradication of rinderpest». Revue Scientifique et Technique de l'OIE 31 (3): 729-746. ISSN 0253-1933. doi:10.20506/rst.31.3.2157. Consultado el 2 de abril de 2021.
- Handa, Hisashi; Ishibuchi, Hisao; Ong, Yew-Soon; Tan, Kay Chen (4 de noviembre de 2014). Proceedings of the 18th Asia Pacific Symposium on Intelligent and Evolutionary Systems, Volume 1 (en inglés). Springer. ISBN 978-3-319-13359-1. Consultado el 2 de abril de 2021.