Litófilo
En geoquímica, se denomina litófilo a un elemento químico que se encuentra con frecuencia formando parte de óxidos minerales debido a su particular afinidad por el oxígeno,[1] especialmente silicatos gracias a su abundancia natural, lo que justifica el nombre de litófilos (literalmente: que tienen afinidad por las piedras). Básicamente son elementos reactivos del bloque s y del bloque f de la tabla periódica, además de algunos no metales reactivos y de metales de transición de la mitad izquierda del bloque d.
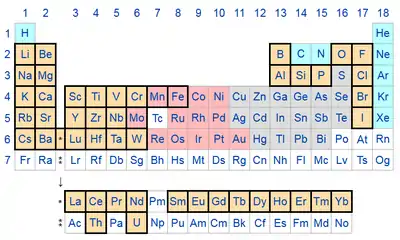
La mayoría de los litófilos forman iones muy estables que tienen una configuración electrónica de gases nobles, si es necesario con electrones adicionales de la subcapa f. Los elementos menos abundantes, como el boro, el silicio y el fósforo, forman enlaces covalentes con oxígeno, a menudo por medio de enlaces π; el fósforo es, por lo tanto, litófilo en presencia de oxígeno, pero siderófilo en medio reductor.
Los litófilos no metálicos, los halógenos y el fósforo, están presentes en la Tierra en forma de sales, iones de metales alcalinos y alcalino-térreos en las pegmatitas con agua de mar. Estos elementos son menos abundantes en la masa terrestre que en el sistema solar, ya que tienden a formar hidruros volátiles, con la excepción del flúor, que forma puentes de hidrógeno y, por lo tanto, tiene una volatilidad reducida; su abundancia natural en la corteza terrestre es en cambio comparable a la del sistema solar, porque en la corteza abundan en comparación con el resto del planeta. Los demás elementos litófilos son aún más abundantes en la corteza terrestre que en el sistema solar debido a su afinidad por el oxígeno. Este es particularmente el caso del rubidio, el estroncio y el bario, que por sí solos representan más de la mitad de la masa de todos los elementos de número atómico mayor que el del hierro en la corteza terrestre.
Otros metales de transición exhiben afinidades litófilas y siderófilas, incluidos el cromo, el manganeso, el hierro y el molibdeno, cuya abundancia natural se reduce significativamente en la corteza terrestre en comparación con la del sistema solar. Se sospecha su alta abundancia en el núcleo de la Tierra, lo que se explicaría por el hecho de que la atmósfera terrestre no se enriqueció en oxígeno hasta después de la formación de la Tierra, bajo el efecto de la fotosíntesis clorofílica.
Su afinidad por el oxígeno mantuvo a los elementos litófilos a distancia de la tecnología humana hasta la llegada de la electrólisis, que hizo posible extraerlos de sus minerales. Gracias a esta innovación, muchos metales litófilos se han vuelto indispensables como agentes reductores (sodio, magnesio o calcio) o como metales estructurales (magnesio, aluminio, titanio o vanadio). Sin embargo, al requerir mucha energía su extracción, sus sectores industriales deben adaptarse a los costes de la energía.
Referencias
- Kovács József – Ravasz Csaba. Földtan II – Ásványok és kőzetek alapfogalmai. Műszaki Kiadó (1981). ISBN 963-10-4249-9
Véase también
- Clasificación geoquímica de Goldschmidt:
- Victor Moritz Goldschmidt
- Elemento incompatible
- Grupos de elementos en geoquímica: REE (LREE y HREE)-LILE-HFSE-MRFE