Magnesio quelatasa
La magnesio quelatasa es una enzima formada por tres componentes que cataliza la inserción de un ion magnesio (Mg2+
) dentro de un anillo de protoporfirina IX. Este es el primer paso en la síntesis de la bacterioclorofila. Como resultado, se cree que la magnesio quelatasa juega un importante papel en la canalización de intermediarios hacia la vía de la bacterioclorofila en respuesta a condiciones en las cuales es posible el crecimiento fotosintético.
| Magnesio quelatasa | ||||
|---|---|---|---|---|
 | ||||
| Estructuras disponibles | ||||
| PDB | ||||
| Identificadores | ||||
| Identificadores externos |
Bases de datos de enzimas
| |||
| Número EC | 6.6.1.1 | |||
| Número CAS | 9074-88-8 | |||
| Ortólogos | ||||
| Especies |
| |||
| PubMed (Búsqueda) |
| |||
| PMC (Búsqueda) |
| |||
| Magnesio quelatasa subunidad ChlI | ||
|---|---|---|
| Identificadores | ||
| Símbolo | Mg_chelatse_chII | |
| Pfam | PF01078 | |
| InterPro | IPR000523 | |
| Magnesio quelatasa subunidad CobN | ||
|---|---|---|
| Identificadores | ||
| Símbolo | CobN/Mg_chltase | |
| Pfam | PF02514 | |
| InterPro | IPR003672 | |
La reacción catalizada es la siguiente:
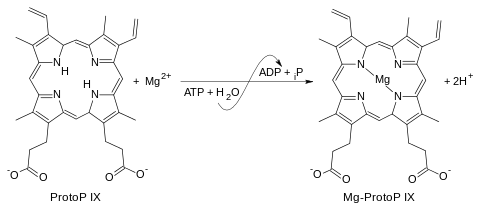
+ H
2O ADP + fosfato + Mg-protoporfirina IX + 2 H+
Los cuatro sustratos de esta enzima son: ATP, protoporfirina IX, Mg2+
y H
2O; mientras que sus cuatro productos son ADP, fosfato inorgánico, Mg-protoporfirina IX y H+
.
Esta enzima pertenece a la familia de las ligasas, específicamente a aquellas ligasas que forman un enlaces nitrógeno-D-metal en compuestos de coordinación. El nombre sistemático de esta clase de enzimas es Mg-protoporfirina IX magnesio-liasa. Otros nombres de uso común pueden ser protoporfirina IX magnesio quelatasa, protoporfirina IX Mg-quelatasa, magnesio-quelatasa, Mg-quelatasa, y Mg-protoporfirina IX magnesio-liasa. Esta enzima participa en el metabolismo de las porfirinas y clorofila.
Referencias
- Walker CJ, Weinstein JD (1991). «In vitro assay of the chlorophyll biosynthetic enzyme Mg-chelatase: resolution of the activity into soluble and membrane-bound fractions». Proc. Natl. Acad. Sci. U.S.A. 88 (13): 5789-93. PMC 51963. PMID 11607197. doi:10.1073/pnas.88.13.5789.
- Walker CJ, Willows RD (Pt 2). «Mechanism and regulation of Mg-chelatase». Biochem. J. 327: 321-33. PMC 1218797. PMID 9359397.
- Al-Karadaghi S; Hansson, A; Hansson, M; Olsen, JG; Gough, S; Willows, RD; Al-Karadaghi, S (2001). «Interplay between an AAA module and an integrin I domain may regulate the function of magnesium chelatase». J. Mol. Biol. 311 (1): 111-22. PMID 11469861. doi:10.1006/jmbi.2001.4834.