Metilcrotonil-CoA carboxilasa
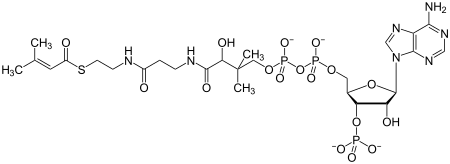
La metilcrotonil-CoA carboxilasa (MCC) (EC 6.4.1.4) es una enzima que cataliza la reacción de carboxilación del ácido 3-metilcrotónico (vía éster con la coenzima A) a ácido 3-metilglutacónico.[3]
- 3-metilcrotonoil-CoA + HCO3- + ATP 3-metilglutaconil-CoA + ADP + fosfato
| Metilcrotonil-CoA carboxilasa 1 (alfa)[1] | ||||
|---|---|---|---|---|
| Estructuras disponibles | ||||
| PDB | ||||
| Identificadores | ||||
| Símbolo | MCC1 (HGNC: 6936) | |||
| Identificadores externos |
Bases de datos de enzimas
| |||
| Número EC | 6.4.1.4 | |||
| Locus | Cr. 3 q27.1 | |||
| Estructura/Función proteica | ||||
| Tamaño | 725 (aminoácidos) | |||
| Ortólogos | ||||
| Especies |
| |||
| Entrez |
| |||
| UniProt |
| |||
| RefSeq (ARNm) |
| |||
| PubMed (Búsqueda) |
| |||
| PMC (Búsqueda) |
| |||
| Metilcrotonil-CoA carboxilasa 2 (beta)[2] | ||||
|---|---|---|---|---|
| Estructuras disponibles | ||||
| PDB | ||||
| Identificadores | ||||
| Símbolo | MCC2 (HGNC: 6937) | |||
| Identificadores externos |
Bases de datos de enzimas
| |||
| Número EC | 6.4.1.4 | |||
| Locus | Cr. 5 q12-q13 | |||
| Estructura/Función proteica | ||||
| Tamaño | 563 (aminoácidos) | |||
| Ortólogos | ||||
| Especies |
| |||
| Entrez |
| |||
| UniProt |
| |||
| RefSeq (ARNm) |
| |||
| PubMed (Búsqueda) |
| |||
| PMC (Búsqueda) |
| |||
Utiliza como cofactor la biotina. Se localiza en la mitocondria. Usa bicarbonato como fuente del grupo carboxilo para catalizar la carboxilación de un carbono adyacente a un carbonilo, llevando así a cabo la cuarta etapa del metabolismo del aminoácido esencial leucina.[4]
Isozimas
En el ser humano se conocen dos isozimas de la metilcrotonil-CoA carboxilasa:
- Metilcrotonil-CoA carboxilasa 1 o alfa. MCC1 o MCCA. Contiene un dominio del unión del ATP, un dominio biotina carboxilasa y un dominio de unión de la biotina.[5]
- Metilcrotonil-CoA carboxilasa 2 o beta. MCC2 o MCCB. Contiene un dominio carboxiltransferasa.[6]
La enzima se presenta como un dodecámero compuesto probablemente por seis unidades alfa que contienen biotina y seis unidades beta.[5][6]
Función
Durante la degradación de los aminoácidos de cadena ramificada, la metilcrotonil-CoA carboxilasa lleva a cabo en una sola etapa la rotura de la leucina en acetil-CoA y acetoacetato.[7] La MCC cataliza la carboxilación del 3-metilcrotonil-CoA a 3-metilglutaconil-CoA. El 3-metilglutaconil-CoA es entonces hidratado para producir 3-hidroxi-3-metilglutaril-CoA. El 3-hidroxi-3-metilglutaril-CoA es roto en dos moléculas, acetil-CoA y acetoacetato.
Las mutuaciones puntuales y los borrados en los genes que codifican la MCC pueden causar la deficiencia en MCC, un error en el metabolismo que se presenta con vómitos, acidosis metabólica y concentración muy baja de glucosa y carnitina en el plasma.[8]
Mecanismo
El bicarbonato es activado por la adición de ATP, incrementándose así la reactividad del bicarbonato. Una vez el bicarbonato está activado, la porción biotina de la metilcrotonil-CoA carboxilasa realiza un ataque nucleófilico sobre el bicarbonato activado para formar la carboxibiotina que queda unida a la enzima. La porción carboxibiotina de la MCC puede entonces realizar un ataque nucleofílico transfiriendo el grupo carboxilo al sustrato, 3-metilcrotonil-CoA, para formar 3-metilglutaconil-CoA.[7]
Regulación
La metilcrotonil-CoA carboxilasa no es regulada por las moléculas pequeñas o por factores hormonales y de la dieta.[8]
Referencias
- «MCCC1». Archivado desde el original el 20 de mayo de 2011. Consultado el 1 de noviembre de 2011.
- «MCCC2». Archivado desde el original el 20 de mayo de 2011. Consultado el 1 de noviembre de 2011.
- «ENZYME entry: EC 6.4.1.4». Consultado el 31 de octubre de 2011.
- Bruice, Paula Y. Organic Chemistry. New Jersey: Prentice Hall, 2001. 1010-1011.
- «Methylcrotonoyl-CoA carboxylase subunit alpha, mitochondrial». Consultado el 1 de noviembre de 2011.
- «Methylcrotonoyl-CoA carboxylase beta chain, mitochondrial». Consultado el 1 de noviembre de 2011.
- Berg, Jeremy M., John L. Tymoczko, Lubert Stryer. Biochemistry. New York: Freeman, 2002. 652-653.
- Stipanuk, Martha H. Biochemical and Physiological Aspects of Human Nutrition. New York: Saunders, 2000. 535-536.