Microbialito
Las microbialitas o microbialitos son estructuras organo-sedimentarias bénticas formadas por la acreción, atrapamiento o precipitación mineral mediada por actividad microbiana.[1] Los microbialitos también pueden definirse como tapetes microbianos con capacidad de litificación.[2]
Evolución
Las microbialitas jugaron un papel importante en la evolución de la atmósfera terrestre, ya que fueron nichos ancestrales en donde surgieron los primeros metabolismos microbianos capaces de liberar oxígeno. Las microbialitas saturaron con oxígeno a los sistemas costeros y posteriormente la atmósfera primitiva, cambiándola de un estado reducido a un estado oxidado.[3]
Las microbialitas fósiles (también llamados estromatolitos) del Precámbrico y Fanerozoico son una de las primeras evidencias de vida comunal. Las microbialitas más antiguas están datadas en 3.5 mil millones de años.[4]
La evidencia fósil sugiere que los organismos productores de microbialitas fueron una forma de vida muy abundante a inicios del Arqueano hasta finales del Proterozoico, hasta que sus comunidades decrecieron por depredación de foraminíferos y otros microorganismos eucariotas.[5]
Distribución
Las microbialitas modernas (menos de 20 mil años de antigüedad) vivas son raras y se pueden encontrar confinadas en lugares como:
- Lagos cráter: Blue Lake (Australia), Lago Satonda (Indonesia), Lago Dziani (Mayotte), Lago Alchichica (México), Lago Vai Lahi y Vai Sii (Tonga), Lago Salda (Turquía)
- Lagos/lagunas salinas/hipersalinas: Lago Piramidal y Great Salt Lake (Estados Unidos), Lago Van (Turquía), Laguna Brava y Laguna Tebinquiche (Chile).
- Lagos alcalinos: Lago Thetis (Australia), Lago Sarmiento (Chile), Lago Nuoertu y Huhejaran (China), Lago Mono (Estados Unidos), Lago Turkana (Kenia), Lago Petukhovskoe (Rusia)
- Lagos/lagunas de agua dulce: Lagoa Salgada (Brasil), Laguna negra (Argentina), Lagunas de ruidera (España), Laguna Bacalar (México), Lago Richomond (Australia), Lago Pavillion (Canadá), Green Lake (Estados Unidos)
- Pozas alcalinas: Pozas azules cuatro ciénagas (México)
- Minas abiertas abandonadas: Clinton Creek (Canadá), Río Tinto (España)
- Sistemas marinos/estuarios/esteros: Shark Bay (Australia), High Borne cay (Bahamas), Arrecife Tikehau (Polinesias francesas), Cayo Coco (Cuba), Lago Clifton (Australia).[6]
Formación de microbialitas
La formación de microbialitas es compleja y es un proceso continuo de precipitación y disolución, donde diferentes metabolismos microbianos están acoplados y existe un alto índice de saturación iónico en el agua.[7]
Las microbialitas tienen dos posibles mecanismos de génesis: 1) Acreción/atrapamiento: cuando los microorganismos atrapan activamente materia orgánica, detritos o material mineral mediante sustancias poliméricas extra celulares (SPEs).[8]
2) Precipitación: puede ser por deposición inorgánica, sedimentación o por influencia pasiva de metabolismos microbianos.[9] También puede haber una precipitación por saturación del microambiente cuando se degradan rápidamente las sustancias poliméricas extracelulares provocando una saturación de iones.[10]
Composición
Las microbialitas están formadas por capas conformados por un componente orgánico y otro mineral.[11]
El componente orgánico es un elaborado tapete microbiano donde interaccionan diferentes comunidades de microorganismos con diferentes metabolismos y crean un micro nicho donde coexisten organismos fotótrofos oxigénicos y anoxigénicos, fijadores de nitrógeno, reductores del azufre, metanotrofos, metanógenos, oxidadores de hierro, y una infinidad de descomponedores heterotróficos..[12]
El componente mineral está compuesto de carbonatos generalmente de carbonatos de calcio y de magnesio, aunque también pueden existir sinterizados siliceos es decir silicatos e incluir formas minerales de azufre, hierro (pirita) o fósforo.[13]
El carbonato suele ser un tipo de automicrita autogénica, por lo tanto, precipita in situ. Los microbialitos pueden ser vistos como un tipo de roca sedimentaria biogénica donde los constructores del arrecife son microbios y la precipitación de carbonato es inducida.
Los microorganismos pueden precipitar carbonato tanto en aguas superficiales como en aguas profundas.[14]
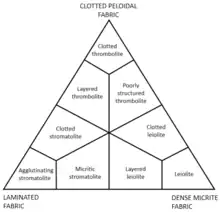
Clasificación
Las microbialitas pueden ser clasificadas por su morfología estructural en 5 tipos[16]
- Estromatolitos: cuando estos crecen de manera laminada y finamente estratificada, en capas regularmente paralelas al sustrato.
- Trombolitos: cuando no existe un patrón laminado y en su lugar se forman aglomeraciones o clusters esponjosos cumuliformes que crecen concéntricamente.
- Dendrolitos: cuando existe un estructura interna de crecimiento de manera dendrítica o ramificada.
- Leiolitos: cuando su estructura no tiene ningún tipo de macro estructura interna y tienen una estructura afanítica, es decir se componen por grano fino, característica de rocas ígneas.
- Oncolitos: cuando se genera una capa estratificada alrededor de un canto rodado y este canto rodado queda completamente embebido en el crecimiento concéntrico de su propia estructura.
Microbios que producen microbialitos

Los microorganismos que precipitan carbonato para construir microbialitos son mayormente procariontes, es decir bacterias y arqueas. Las bacterias que más precipitan carbonatos son las cianobacterias y las bacterias reductoras del azufre.[17] Las bacterias heterótroficas principalmente Alphaproteobacteria están también relacionadas con una precipitación por su actividad en la degradación de sustancias poliméricas extracelulares de cianobacterias y su capacidad de realizar fotosíntesis anoxigenica.[18] Las Arqueas a menudo extremófilas pueden vivir en las profundidades del océano también formando microbialitos. Por tanto los microorganismos pueden precipitar carbonatos tanto en lugares poco profundos como en sistemas profundos.
Los microorganismos eucariontes a comparación de los procariontes producen menor cantidad de carbonatos.
Interés por estudiar los microbialitos
Existe un gran interés por estudiar las microbialitas fósiles en el campo de paleontología ya que aportan datos relevantes del paleoclima y funcionan como indicadores bioclimáticos.[19] También hay un interés por estudiarlas en el campo de la astrobiología, por ser una de las primeras formas de vida, se esperaría encontrar indicios de estas estructuras en otros planetas.[20]
El estudio de microbialitas modernas puede dar información relevante y servir como indicadores ambientales para el manejo y conservación de zonas naturales protegidas.[21]. Debido a su capacidad para formar minerales y precipitar material detrítico, se han sugerido aplicaciones biotecnológicas y de bioremediación en sistemas acuáticos para el secuestro de dióxido de carbono, ya que las microbialitas pueden funcionar como sumideros de carbono[22]
Referencias
- Burne, Robert V.; Moore, Linda S. (1987). «Microbialites: Organosedimentary Deposits of Benthic Microbial Communities». PALAIOS 2 (3): 241. ISSN 0883-1351. doi:10.2307/3514674. Consultado el 6 de octubre de 2019.
- Dupraz, Christophe; Visscher, Pieter T. (2005-09). «Microbial lithification in marine stromatolites and hypersaline mats». Trends in Microbiology 13 (9): 429-438. ISSN 0966-842X. doi:10.1016/j.tim.2005.07.008. Consultado el 7 de octubre de 2019.
- Laval, Bernard; Cady, Sherry L.; Pollack, John C.; McKay, Christopher P.; Bird, John S.; Grotzinger, John P.; Ford, Derek C.; Bohm, Harry R. (2000-10). «Modern freshwater microbialite analogues for ancient dendritic reef structures». Nature 407 (6804): 626-629. ISSN 0028-0836. doi:10.1038/35036579. Consultado el 7 de octubre de 2019.
- Awramik, S. M. (19 de noviembre de 1971). «Precambrian Columnar Stromatolite Diversity: Reflection of Metazoan Appearance». Science 174 (4011): 825-827. ISSN 0036-8075. doi:10.1126/science.174.4011.825. Consultado el 7 de octubre de 2019.
- Bernhard, J. M.; Edgcomb, V. P.; Visscher, P. T.; McIntyre-Wressnig, A.; Summons, R. E.; Bouxsein, M. L.; Louis, L.; Jeglinski, M. (28 de mayo de 2013). «Insights into foraminiferal influences on microfabrics of microbialites at Highborne Cay, Bahamas». Proceedings of the National Academy of Sciences 110 (24): 9830-9834. ISSN 0027-8424. doi:10.1073/pnas.1221721110. Consultado el 7 de octubre de 2019.
- Desnues, Christelle; Rodriguez-Brito, Beltran; Rayhawk, Steve; Kelley, Scott; Tran, Tuong; Haynes, Matthew; Liu, Hong; Furlan, Mike et al. (2008-03). «Biodiversity and biogeography of phages in modern stromatolites and thrombolites». Nature 452 (7185): 340-343. ISSN 0028-0836. doi:10.1038/nature06735. Consultado el 7 de octubre de 2019.
- Ruvindy, Rendy; White III, Richard Allen; Neilan, Brett Anthony; Burns, Brendan Paul (29 de mayo de 2015). «Unravelling core microbial metabolisms in the hypersaline microbial mats of Shark Bay using high-throughput metagenomics». The ISME Journal 10 (1): 183-196. ISSN 1751-7362. doi:10.1038/ismej.2015.87. Consultado el 7 de octubre de 2019.
- Frantz, C. M.; Petryshyn, V. A.; Corsetti, F. A. (22 de junio de 2015). «Grain trapping by filamentous cyanobacterial and algal mats: implications for stromatolite microfabrics through time». Geobiology 13 (5): 409-423. ISSN 1472-4677. doi:10.1111/gbi.12145. Consultado el 7 de octubre de 2019.
- Gautret, P.; Camoin, G.; Golubic, S.; Sprachta, S. (1 de julio de 2004). «Biochemical Control of Calcium Carbonate Precipitation in Modern Lagoonal Microbialites, Tikehau Atoll, French Polynesia». Journal of Sedimentary Research 74 (4): 462-478. ISSN 1527-1404. doi:10.1306/012304740462. Consultado el 7 de octubre de 2019.
- Saghaï, Aurélien; Zivanovic, Yvan; Moreira, David; Benzerara, Karim; Bertolino, Paola; Ragon, Marie; Tavera, Rosaluz; López-Archilla, Ana Isabel et al. (19 de agosto de 2016). «Comparative metagenomics unveils functions and genome features of microbialite-associated communities along a depth gradient». Environmental Microbiology 18 (12): 4990-5004. ISSN 1462-2912. doi:10.1111/1462-2920.13456. Consultado el 7 de octubre de 2019.
- Centeno, Carla M.; Legendre, Pierre; Beltrán, Yislem; Alcántara-Hernández, Rocío J.; Lidström, Ulrika E.; Ashby, Matthew N.; Falcón, Luisa I. (2 de agosto de 2012). «Microbialite genetic diversity and composition relate to environmental variables». FEMS Microbiology Ecology 82 (3): 724-735. ISSN 0168-6496. doi:10.1111/j.1574-6941.2012.01447.x. Consultado el 7 de octubre de 2019.
- White, Richard Allen; Chan, Amy M.; Gavelis, Gregory S.; Leander, Brian S.; Brady, Allyson L.; Slater, Gregory F.; Lim, Darlene S. S.; Suttle, Curtis A. (28 de enero de 2016). «Metagenomic Analysis Suggests Modern Freshwater Microbialites Harbor a Distinct Core Microbial Community». Frontiers in Microbiology 6. ISSN 1664-302X. doi:10.3389/fmicb.2015.01531. Consultado el 7 de octubre de 2019.
- Dupraz, Christophe; Reid, R. Pamela; Braissant, Olivier; Decho, Alan W.; Norman, R. Sean; Visscher, Pieter T. (2009-10). «Processes of carbonate precipitation in modern microbial mats». Earth-Science Reviews 96 (3): 141-162. ISSN 0012-8252. doi:10.1016/j.earscirev.2008.10.005. Consultado el 7 de octubre de 2019.
- Flügel, Erik. (2010). Microfacies of carbonate rocks : analysis, interpretation and application (2nd ed edición). Springer. ISBN 9783642037962. OCLC 663093942. Consultado el 6 de octubre de 2019.
- Schmid, D.U. (1996). «Mikrobolithe und Mikroinkrustierer aus dem Oberjura». Profil 9: 101-251.
- Erik., Flügel (2010). Microfacies of carbonate rocks : analysis, interpretation and application. Munnecke, Axel. (2nd edición). Heidelberg: Springer. ISBN 9783642037962. OCLC 663093942.
- Chagas, Anderson A.P.; Webb, Gregory E.; Burne, Robert V.; Southam, Gordon (2016-11). «Modern lacustrine microbialites: Towards a synthesis of aqueous and carbonate geochemistry and mineralogy». Earth-Science Reviews 162: 338-363. ISSN 0012-8252. doi:10.1016/j.earscirev.2016.09.012. Consultado el 6 de octubre de 2019.
- Gérard, Emmanuelle; De Goeyse, Siham; Hugoni, Mylène; Agogué, Hélène; Richard, Laurent; Milesi, Vincent; Guyot, François; Lecourt, Léna et al. (22 de mayo de 2018). «Key Role of Alphaproteobacteria and Cyanobacteria in the Formation of Stromatolites of Lake Dziani Dzaha (Mayotte, Western Indian Ocean)». Frontiers in Microbiology 9. ISSN 1664-302X. doi:10.3389/fmicb.2018.00796. Consultado el 7 de julio de 2020.
- Webb, Gregory E.; Kamber, Balz S. (2000-05). «Rare earth elements in Holocene reefal microbialites: a new shallow seawater proxy». Geochimica et Cosmochimica Acta 64 (9): 1557-1565. ISSN 0016-7037. doi:10.1016/s0016-7037(99)00400-7. Consultado el 7 de octubre de 2019.
- Noffke, Nora (2015-02). «Ancient Sedimentary Structures in the <3.7 Ga Gillespie Lake Member, Mars, That Resemble Macroscopic Morphology, Spatial Associations, and Temporal Succession in Terrestrial Microbialites». Astrobiology 15 (2): 169-192. ISSN 1531-1074. doi:10.1089/ast.2014.1218. Consultado el 7 de octubre de 2019.
- Zhu, Tingting; Dittrich, Maria (20 de enero de 2016). «Carbonate Precipitation through Microbial Activities in Natural Environment, and Their Potential in Biotechnology: A Review». Frontiers in Bioengineering and Biotechnology 4. ISSN 2296-4185. doi:10.3389/fbioe.2016.00004. Consultado el 7 de octubre de 2019.