Modelo ECW
En química, el modelo ECW es un modelo semicuantitativo que describe y predice la fuerza de las interacciones de ácido Lewis - base de Lewis. Muchas reacciones químicas pueden describirse como reacciones ácido-base, por lo que los modelos para tales interacciones son de interés potencialmente amplio. El modelo asignó inicialmente los parámetros E y C a todos y cada uno de los ácidos y bases. El modelo se expandió posteriormente al modelo ECW para cubrir reacciones que tienen un término de energía constante, W, que describe los procesos que preceden a la reacción ácido-base. Este modelo cuantitativo se discute a menudo con la teoría cualitativa de HSAB, que también busca racionalizar el comportamiento de diversos ácidos y bases.
Historia del problema
Ya en 1938, GN Lewis señaló que la fuerza relativa de un ácido o base dependía de la base o el ácido contra el cual se medía.[1] Ningún orden de rango único de ácido o fuerza de base puede predecir la energía de la reacción cruzada. Considere el siguiente par de reacciones ácido-base:
- 4F-C6H4OH + OEt2 −ΔH = 5.94 kcal/mol
- 4F-C6H4OH + SMe2 −ΔH = 4.73 kcal/mol
Estos datos sugieren que OEt2 es una base más fuerte que SMe. Lo contrario se encuentra, sin embargo, cuando I2 es el ácido:
- I2 + OEt2 −ΔH = 4.16 kcal/mol
- I2 + SMe2 −ΔH = 7.63 kcal/mol
Ecuación E y C
El modelo EC se adapta al fallo de las descripciones de parámetros individuales de ácidos y bases. En 1965, Russell S. Drago y Bradford Wayland publicaron la ecuación de dos términos, de manera que cada ácido y cada base se describen mediante dos parámetros.[2] Cada ácido se caracteriza por una EA y una CA. Cada base se caracteriza igualmente por su propia EB y CB. Los parámetros E y C se refieren, respectivamente, a las contribuciones electrostáticas y covalentes a la fuerza de los enlaces que formarán el ácido y la base. Estos parámetros se han obtenido empíricamente utilizando entalpías para aductos que forman solo enlaces σ entre el ácido y la base, así como aductos que no tienen repulsión estérica entre el ácido y la base.
- −ΔH = EAEB + CACB
Esta ecuación reproduce y predice la entalpía, ΔH, de una reacción entre muchos ácidos y bases. ΔH es una medida de la fuerza de la unión entre el ácido y la base, tanto en la fase gaseosa como en medios de solvatación débil. Los efectos de la entropía son ignorados. Una presentación matricial de la ecuación realza su utilidad.[3]
Cuatro valores, dos E y dos C fueron asignados como referencias. EA y CA de I2 fueron elegidos como estándares. Dado que I2 tiene poca tendencia a someterse a un enlace electrostático, al parámetro EA se le asignó un valor pequeño, 0.5, mientras que el valor de CA para la propiedad covalente se estableció en 2.0. Para los dos parámetros básicos, EB para CH3 C (O) N (CH3)2 (DMA) se estableció en 2.35 y CB para (C2 H5)2 S, sulfuro de dietilo, se estableció en 3.92. La fijación de los parámetros de esta manera impuso el modelo electrostático covalente en el conjunto de datos al fijar los productos EAEB y CACB de los aductos de DMA y (C2H5)2S con yodo, y estos cuatro valores asegurados Que ninguno de los parámetros tenía valores negativos. Debido al aumento de los datos de entalpía que se hicieron disponibles desde que se propuso por primera vez la ecuación EC, los parámetros se han mejorado. En este artículo se encuentra un conjunto de selección de los números E y C recomendados y el conjunto completo está disponible en la literatura.[4][5] Mezclar los números E y C de diferentes conjuntos resultará en cálculos incorrectos y se evitará.[6]
Modelo ECW
En el modelo ECW, se agregó un nuevo término W a la ecuación.
- −ΔH = EAEB + CACB + W
El término W representa una energía constante para la escisión de un ácido o base dimérico. Por ejemplo, la entalpía de escisión del [Rh(CO)2Cl]2 por la base B implica dos pasos. El primer paso es la escisión del dímero, que es W :
- ½ [Rh(CO)2Cl]2 → Rh(CO)2Cl W = -10.39 kcal/mol
El segundo paso es la unión de B al monómero RhCl(CO)2. En este caso, W = -10.39 kcal / mol.
En otros casos, W es la entalpía necesaria para escindir el enlace de hidrógeno interno del ácido H-unión (CF3)3COH. W también es útil para una reacción de desplazamiento de base en medios con poco solvente:
- F3B-OEt2 → BF3 + OEt2
Para cualquier base, se observa una contribución de energía constante para la ruptura de la F3B-OEt2 fianza. Un estudio ECW de las entalpías de una serie de bases produce un valor de W que corresponde a la entalpía de disociación del enlace F3B-OEt2. Los parámetros EA y CA que resultan son los de BF3 sin complejos.
Una presentación gráfica del modelo ECW
Una presentación gráfica de este modelo muestra claramente que no hay un solo orden de fuerza de base o ácido, un punto que a menudo se pasa por alto, y enfatiza que la magnitud de las interacciones de ácidos y bases requiere dos parámetros (E y C) para tener en cuenta las interacciones.[7] La ecuación EC del modelo ECW.
- −ΔH = EAEB + CACB
se puede reorganizar en una forma que se puede trazar como una línea recta.
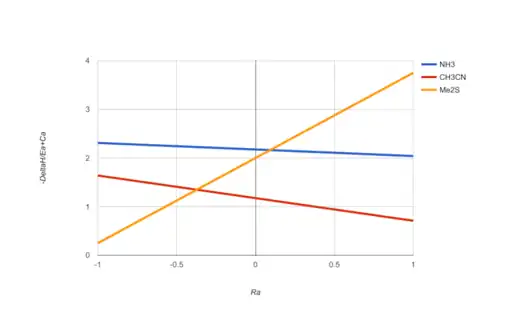
En un gráfico de Cramer-Bopp para bases de Lewis, el parámetro Ra refleja el modo de unión de un potencial compañero de ácido de Lewis, desde interacciones puramente electrostáticas (Ra = −1) a interacciones puramente covalentes (Ra = +1). El parámetro refleja la fuerza de la interacción de unión. La gráfica que se muestra aquí permite la comparación de tres bases de Lewis elegidas: acetonitrilo, amoníaco y sulfuro de dimetilo. El yodo ácido de Lewis (Ra = 0.6) interactuará más fuertemente con sulfuro de dimetilo y menos fuertemente con acetonitrilo, mientras que el trietilgallio (Ra = −0.65) interactuará más fuertemente con amoníaco y menos fuertemente con sulfuro de dimetilo. La gráfica también muestra que el amoníaco es una base de Lewis más fuerte que el acetonitrilo, independientemente de su compañero de ácido de Lewis, mientras que las concentraciones relativas de amoníaco y sulfuro de dimetilo como bases de Lewis dependen de las características de enlace del ácido de Lewis, orden de intercambio cuando Ra = 0.1. (NB: Guesstimate). La gráfica de Cramer-Bopp se desarrolló como una herramienta visual para comparar la resistencia de la base de Lewis con el rango de posibles parejas de ácidos de Lewis, y se puede construir una gráfica similar para examinar los ácidos de Lewis seleccionados contra la gama de posibles bases de Lewis. Las referencias 4, 7, 11 y 13 contienen presentaciones gráficas que definen el orden de clasificación de la resistencia de muchos ácidos y bases de Lewis.
Otros aspectos y ampliaciones del modelo ECW
Como se mencionó anteriormente, los parámetros E y C se obtienen de entalpías de formación de aductos en las que el enlace entre el ácido y la base es una interacción σ y aductos que no tienen repulsión estérica entre el ácido y la base. Como resultado, los parámetros E y C se pueden usar para obtener información sobre el enlace pi. Cuando el enlace pi contribuye a la entalpía medida, la entalpía calculada a partir de los parámetros E y C será menor que la entalpía medida y la diferencia proporciona una medida de la extensión de la contribución del enlace pi.[8][9]
La ᐃH calculada para la reacción de Me3B con Me3N es mayor que la observada. Esta discrepancia se atribuye a la repulsión estérica entre los grupos metilo en B y N. La diferencia entre los valores calculados y observados se puede tomar como la cantidad del efecto estérico, un valor que de otra manera no sería posible. Los efectos estéricos también se han identificado con (CH3)3SnCl y con Cu(HFacac)2 .
El uso de los parámetros E y C se ha extendido para analizar los cambios espectroscópicos que ocurren durante la formación de aductos.[10] Por ejemplo, el cambio de la frecuencia de estiramiento del fenol OH, Δχ, que se produce en la formación de aductos se ha analizado mediante la siguiente ecuación:
- Δχ = ΕA*EB + CA*CB + W*
donde los asteriscos en EA y CA para fenol indican que el aceptor se mantiene constante y el cambio de frecuencia se mide a medida que se varía la base. Los asteriscos también indican que los parámetros de fenol son aquellos para los cambios de frecuencia y no los de entalpías. Un análisis como este proporciona una base para usar los parámetros EB y CB como una escala de referencia de las fortalezas del donante para los cambios de frecuencia. Este tipo de análisis también se ha aplicado a otros cambios espectroscópicos (RMN, EPR, UV-vis, IR, etc.) que acompañan a la formación de aductos. Cualquier propiedad fisicoquímica, Δχ, que esté dominada por la interacción σ donante-aceptor puede correlacionarse con los parámetros E y C derivados de la entalpía.
Las ecuaciones de ECW permiten correlacionar y predecir las entalpías de la formación de aductos de las interacciones neutras donante-aceptor para las cuales la transferencia de electrones es limitada. Para las reacciones en fase gaseosa entre cationes y donantes neutros, existe una transferencia de electrones significativa. La extensión del modelo ECW a las interacciones de base de Lewis catiónicas ha llevado al modelo ECT.[11][12] Otros han llegado a la conclusión de que el modelo ECW "se encuentra generalmente útil en muchos campos de la química de soluciones y la bioquímica".[13]
|
|
Notas
- units for EA, and CA are (kcal/mol)1/2 and W is kcal/mol
- bis(hexafloroacetylacetonato)copper(II)
- zinc tetraphenylporphine
- cobalt(II) protoporhyrin IX dimethyl esterIX
- methylcobaloxime
- Units for EBand CB are (kcal/mol)1/2
Referencias
- Lewis GN (1938) Ácidos y bases Journal of Franklin Institute, 226, 293-313.
- Drago, R. S.; Wayland, B. B. (1965). «A Double-Scale Equation for Correlating Enthalpies of Lewis Acid-Base Interactions». Journal of the American Chemical Society 87: 3571-3577. doi:10.1021/ja01094a008.
- Drago, RS, Vogel, GC y Needham, TE (1971) Una ecuación de cuatro parámetros para predecir las entalpías de la formación de aductos. Revista de la American Chemical Society, 93, 6014-6026
- Vogel G. C.; Drago, R. S. (1996). «The ECW Model». Journal of Chemical Education 73: 701-707. Bibcode:1996JChEd..73..701V. doi:10.1021/ed073p701.
- Drago, RS, Dadmun, AP y Vogel, GC (1993) Incorporación de nuevos donantes al modelo E y C. Química Inorgánica 32 2473-2479.
- Drago, RS, Ferris, DC y Wong, NM (1990) Un método para el análisis y la predicción de entalpías de moléculas de iones en fase gaseosa. Revista de la American Chemical Society, 112, 8953-8961
- Cramer, RE y Bopp, TT (1977) Gran gráfica de E y C. Representación gráfica de las entalpías de formación de aductos para ácidos y bases de Lewis. Revista de educación química 54 612-613
- Drago, R. S.; Bilgrien, C. J. (1988). «Inductive transfer and coordination of ligands in metal-metal bonded systems». Polyhedron 7: 1453-1468. doi:10.1016/S0277-5387(00)81774-X.
- Drago, R, S. (1982). «The question of a synergistic metal-metal interaction leading to .pi.-back-bond stabilization in dirhodium tetrabutyrate adducts». Inorg. Chem. 21: 1697-1698. doi:10.1021/ic00134a093.
- Drago, RS y Vogel, GC (1992} Interpretación de cambios espectroscópicos en la formación de aductos y su uso para determinar parámetros electrostáticos y covalentes (E y C) Diario de la American Chemical Society 114, 9527-9532
- Drago, RS Aplicaciones de modelos electrostáticos-covalentes en química, Surfside: Gainesville, FL, 1994.
- Drago, R. Wong N. S. (1996). «The Role of Electron-Density Transfer and Electronegativity in Understanding Chemical Reactivity and Bonding». Journal of Chemical Education 73: 123-129.
- Laurence, C. y Gal, JF. Lewis Básico y escalas de afinidad, datos y medidas, (Wiley 2010) p 51 ISBN 978-0-470-74957-9