Movimiento ameboide
El movimiento ameboide es el modo de locomoción más típico de las células eucariotas adherentes.[1] Se trata de un tipo de movimiento de tipo reptante que se realiza mediante la protrusión del citoplasma de la célula y que implica la formación de pseudópodos ("falsos pies") y urópodos posteriores. Dependiendo del organismo, pueden producirse uno o varios pseudópodos a la vez, pero todo movimiento ameboide se caracteriza por el desplazamiento de organismos con una forma amorfa que no poseen estructuras de motilidad fijas.[2]
El movimiento se produce cuando el citoplasma se desliza y forma un pseudopodio delante para tirar de la célula hacia delante. Algunos ejemplos de organismos que presentan este tipo de locomoción son las amebas (como Amoeba proteus y Naegleria gruberi,)[2] y los mohos limosos, así como algunas células humanas como los leucocitos. Los sarcomas, o cánceres que surgen de las células del tejido conjuntivo, son particularmente adeptos al movimiento ameboide, lo que conduce a su alta tasa de metástasis.
Este tipo de movimiento se ha relacionado con cambios en el potencial de acción. Aunque se han propuesto varias hipótesis para explicar el mecanismo del movimiento ameboide, aún no se conocen bien sus mecanismos exactos.[3][4] El ensamblaje y desensamblaje de los filamentos de actina en las células puede ser importante para los mecanismos bioquímicos y biofísicos que contribuyen a diferentes tipos de movimientos celulares tanto en estructuras musculares estriadas como en células no musculares.[5][6] La polaridad confiere a las células bordes delanteros y traseros diferenciados mediante el desplazamiento selectivo de proteínas hacia los polos, y puede desempeñar un papel importante en la quimiotaxis eucariota.[7][8]
Tipos de movimiento ameboide
Arrastre
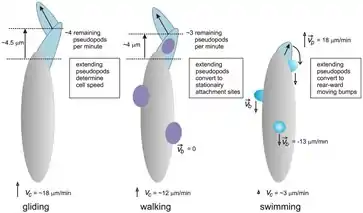
El arrastre es una forma de movimiento ameboide que comienza cuando una extensión de la célula en movimiento (pseudópodo) se adhiere fuertemente a la superficie.[9][10] La mayor parte de la célula tira de sí misma hacia la parte adherida. Repitiendo este proceso, la célula puede desplazarse hasta que la primera zona unida se encuentra en el extremo de la célula, momento en el que se desprende.[9][10] La velocidad a la que las células se arrastran puede variar enormemente, pero en general el arrastre es más rápido que la natación, pero más lento que el deslizamiento sobre una superficie lisa.[9] Sin embargo, el arrastre no es notablemente más lento en superficies irregulares y desiguales, mientras que el deslizamiento se vuelve mucho más lento en tales condiciones[9]. Parece que el reptado puede ser impulsado por actina (véanse las secciones siguientes), dependiendo de la naturaleza de la superficie.[10]
Deslizamiento
El deslizamiento es similar al arrastre, pero se caracteriza por una adhesión mucho menor a la superficie, lo que lo hace más rápido en superficies lisas que requieren menos tracción, pero más lento en superficies más difíciles y complicadas.[9] Algunas células se deslizan con el mismo mecanismo que el arrastre, pero con pseudópodos más grandes y menos adhesión a la superficie.[9] Otras células utilizan un método diferente para deslizarse: una pequeña porción de la célula que ya toca la superficie se une a ella, tras lo cual el citoesqueleto empuja o tira de la porción anclada para deslizar la célula hacia delante.[11] Este mecanismo difiere del anterior en que la célula no extiende un pseudópodo, por lo que hay relativamente poca deformación de la célula a medida que avanza.[11]
Nadado
Muchas células procariotas y eucariotas pueden nadar y muchas de ellas tienen flagelos o cilios para ello. Sin embargo, estas estructuras específicas no son necesarias para la natación, ya que hay amebas y otras células eucariotas que carecen de flagelos y cilios, pero pueden nadar, aunque es más lento que arrastrarse o deslizarse.[9][11][12] Se han propuesto dos mecanismos diferentes para la natación ameboide. En el primero, la célula extiende pequeños pseudópodos que se mueven hacia los lados de la célula, actuando como remos.[9][10][12] En el segundo, la célula genera un ciclo de flujo interno, en el que el citoplasma fluye hacia atrás por el borde de la membrana y hacia delante por el centro, generando una fuerza en la membrana que mueve la célula hacia delante.[10][12]
Mecanismo molecular del movimiento celular
Teoría sol-gel
El protoplasma de una ameba está formado por una capa externa denominada ectoplasma que rodea una porción interna llamada endoplasma. El ectoplasma está formado por un semisólido gelatinoso denominado gel plasmático, mientras que el endoplasma está constituido por un fluido menos viscoso denominado sol plasmático. El ectoplasma debe su estado altamente viscoso, en parte, al complejo de actomiosina reticulado. Se cree que la locomoción de una ameba se debe a la conversión sol-gel del protoplasma dentro de su célula. La conversión sol-gel describe los acontecimientos de contracción y relajación forzados por la presión osmótica y otras cargas iónicas".[13]
Por ejemplo, cuando una ameba se mueve, extiende un pseudopodio gelatinoso y citosólico, lo que hace que el citosol más fluido (sol plasmático) fluya tras la porción gelatinosa (gel plasmático), donde se congela en el extremo del pseudopodio. El resultado es la extensión de este apéndice. En el extremo opuesto (posterior) de la célula, el gel plasmático se convierte en sol plasmático y fluye hacia el pseudopodio que avanza. Mientras la célula tenga una forma de agarrarse al sustrato, la repetición de este proceso guía a la célula hacia delante. En el interior de la ameba hay proteínas que pueden activarse para convertir el gel en sol líquido.
El citoplasma está formado en gran parte por actina y la actina está regulada por proteínas de unión a actina. Las proteínas de unión a la actina están reguladas a su vez por iones de calcio; por lo tanto, los iones de calcio son muy importantes en el proceso de conversión sol-gel.[13][1]
Motilidad impulsada por actina
Basándose en algunos modelos matemáticos, estudios recientes plantean la hipótesis de un nuevo modelo biológico para los mecanismos biomecánicos y moleculares colectivos del movimiento celular.[14] Se propone que los microdominios tejen la textura del citoesqueleto y sus interacciones marcan la ubicación para la formación de nuevos sitios de adhesión. Según este modelo, la dinámica de señalización de los microdominios organiza el citoesqueleto y su interacción con el sustrato. A medida que los microdominios desencadenan y mantienen la polimerización activa de los filamentos de actina, su propagación y movimiento en zigzag sobre la membrana generan una red altamente interconectada de filamentos curvos o lineales orientados en un amplio espectro de ángulos con respecto al límite celular. También se ha propuesto que la interacción de los microdominios marca la formación de nuevos sitios de adhesión focal en la periferia celular. La interacción de la miosina con la red de actina genera entonces la retracción/desplazamiento de la membrana, el flujo retrógrado y fuerzas contráctiles para el movimiento hacia delante. Por último, la aplicación continua de tensión en los antiguos sitios de adhesión focal podría dar lugar a la activación de la calpaína inducida por el calcio y, en consecuencia, al desprendimiento de las adhesiones focales, lo que completa el ciclo.
Además de la polimerización de actina, los microtúbulos también pueden desempeñar un papel importante en la migración celular, en la que interviene la formación de lamelipodios. Un experimento demostró que, aunque los microtúbulos no son necesarios para la polimerización de la actina para crear extensiones lamelipodiales, sí lo son para permitir el movimiento celular.[15]
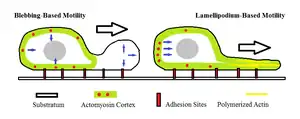
Motilidad impulsada por blebs
Otro de los mecanismos propuestos, el de la "locomoción ameboide impulsada por blebs", sugiere que la actomiosina de la corteza celular se contrae para aumentar la presión hidrostática dentro de la célula. En las células ameboides se produce una protuberancia aproximadamente esférica en la membrana celular, caracterizada por el desprendimiento de la corteza de actomiosina. Este modo de movimiento ameboide requiere que la miosina II desempeñe un papel en la generación de la presión hidrostática que hace que el bleb se extienda.[16] Esto es diferente de la locomoción impulsada por actina, en la que el bleb creado se produce por la polimerización de la actina mientras permanece unida a la corteza de actomiosina y empuja físicamente contra la barrera de la célula. Durante el movimiento ameboide impulsado por la ameboide, se regula el estado sol-gel del citoplasma.[1]
También se ha observado que las vesículas formadas por células móviles experimentan un ciclo de vida aproximadamente uniforme que dura aproximadamente un minuto. Incluye una fase de expansión inicial hacia el exterior en la que la membrana se desprende del citoesqueleto membranoso. A continuación sigue una breve fase estática en la que la presión hidrostática acumulada es suficiente para mantener el tamaño del bleb. A continuación se produce la última fase, caracterizada por la lenta retracción del bleb y la reintroducción de la membrana en la infraestructura del citoesqueleto.[17]
Las células pueden experimentar transiciones rápidas entre el blebbing y la motilidad basada en el lamelipodio como medio de migración. Sin embargo, aún se desconoce la velocidad a la que se producen estas transiciones. Las células tumorales también pueden mostrar transiciones rápidas entre la motilidad ameboide y la motilidad mesenquimal, otra forma de movimiento celular.[18]
Mecanismos de movimiento relacionados
Las células Dictyostelium y los neutrófilos también pueden nadar, utilizando un mecanismo similar al del arrastre.[9][19]
Otra forma unicelular de movimiento mostrada en Euglena se conoce como metabolismo. La base de la teoría sol gel es la interconversión de sol y gel.
Referencias
- Nishigami Y, Ichikawa M, Kazama T, Kobayashi R, Shimmen T, Yoshikawa K, Sonobe S (5 de agosto de 2013). «Reconstruction of active regular motion in amoeba extract: dynamic cooperation between sol and gel states». PLOS ONE 8 (8): e70317. Bibcode:2013PLoSO...870317N. PMC 3734023. PMID 23940560. doi:10.1371/journal.pone.0070317.
- Preston TM, Cooper LG, King CA (Jul–Aug 1990). «Amoeboid locomotion of Naegleria gruberi: the effects of cytochalasin B on cell-substratum interactions and motile behavior». The Journal of Protozoology 37 (4): 6S-11S. PMID 2258833. doi:10.1111/j.1550-7408.1990.tb01139.x.
- Allen RD, Allen NS (1978). «Cytoplasmic streaming in amoeboid movement». Annual Review of Biophysics and Bioengineering 7: 469-95. PMID 352246. doi:10.1146/annurev.bb.07.060178.002345.
- Smirnova T, Segall JE (October 2007). «Amoeboid chemotaxis: future challenges and opportunities». Cell Adhesion & Migration 1 (4): 165-70. PMC 2634101. PMID 19262145. doi:10.4161/cam.1.4.5305.
- Pollard TD (June 2007). «Regulation of actin filament assembly by Arp2/3 complex and formins». Annual Review of Biophysics and Biomolecular Structure 36 (1): 451-77. PMID 17477841. doi:10.1146/annurev.biophys.35.040405.101936.
- Condeelis J (November 1993). «Life at the leading edge: the formation of cell protrusions». Annual Review of Cell Biology 9 (1): 411-44. PMID 8280467. doi:10.1146/annurev.cb.09.110193.002211.
- Swaney KF, Huang CH, Devreotes PN (April 2010). «Eukaryotic chemotaxis: a network of signaling pathways controls motility, directional sensing, and polarity». Annual Review of Biophysics 39 (1): 265-89. PMC 4364543. PMID 20192768. doi:10.1146/annurev.biophys.093008.131228.
- Kaneshiro, Edna S. (1995). «Amoeboid Movement, Cilia, and Flagella». Cell Physiology Source Book. pp. 611-637. ISBN 978-0-12-656970-4. doi:10.1016/B978-0-12-656970-4.50051-8.
- Van Haastert PJ (8 de noviembre de 2011). «Amoeboid cells use protrusions for walking, gliding and swimming». PLOS ONE 6 (11): e27532. Bibcode:2011PLoSO...627532V. PMC 3212573. PMID 22096590. doi:10.1371/journal.pone.0027532.
- Othmer, H. G. (January 2019). «Eukaryotic cell dynamics from crawlers to swimmers». WIREs Computational Molecular Science 9 (1). PMC 6402608. PMID 30854030. doi:10.1002/wcms.1376.
- Heintzelman, Matthew B. (2006). Cellular and Molecular Mechanics of Gliding Locomotion in Eukaryotes. International Review of Cytology 251. pp. 79-129. ISBN 978-0-12-364655-2. PMID 16939778. doi:10.1016/S0074-7696(06)51003-4.
- Barry, Nicholas P.; Bretscher, Mark S. (22 de junio de 2010). «Dictyostelium amoebae and neutrophils can swim». Proceedings of the National Academy of Sciences of the United States of America 107 (25): 11376-11380. Bibcode:2010PNAS..10711376B. PMC 2895083. PMID 20534502. doi:10.1073/pnas.1006327107.
- Rastogi SC (2010). Cell and molecular biology. (3rd edición). New Delhi: New Age International. p. 461. ISBN 9788122430790. Consultado el 29 de octubre de 2014.
- Coskun H, Coskun H (March 2011). «Cell physician: reading cell motion: a mathematical diagnostic technique through analysis of single cell motion». Bulletin of Mathematical Biology 73 (3): 658-82. PMID 20878250. S2CID 37036941. doi:10.1007/s11538-010-9580-x.
- Ballestrem C, Wehrle-Haller B, Hinz B, Imhof BA (September 2000). «Actin-dependent lamellipodia formation and microtubule-dependent tail retraction control-directed cell migration». Molecular Biology of the Cell 11 (9): 2999-3012. PMC 14971. PMID 10982396. doi:10.1091/mbc.11.9.2999.
- Yoshida K, Soldati T (September 2006). «Dissection of amoeboid movement into two mechanically distinct modes». Journal of Cell Science 119 (Pt 18): 3833-44. PMID 16926192. doi:10.1242/jcs.03152.
- Fackler OT, Grosse R (June 2008). «Cell motility through plasma membrane blebbing». The Journal of Cell Biology 181 (6): 879-84. PMC 2426937. PMID 18541702. doi:10.1083/jcb.200802081.
- Bergert M, Chandradoss SD, Desai RA, Paluch E (September 2012). «Cell mechanics control rapid transitions between blebs and lamellipodia during migration». Proceedings of the National Academy of Sciences of the United States of America 109 (36): 14434-9. Bibcode:2012PNAS..10914434B. PMC 3437886. PMID 22786929. doi:10.1073/pnas.1207968109.
- Bae AJ, Bodenschatz E (November 2010). «On the swimming of Dictyostelium amoebae». Proceedings of the National Academy of Sciences of the United States of America 107 (44): E165-6. Bibcode:2010PNAS..107E.165B. PMC 2973909. PMID 20921382. arXiv:1008.3709. doi:10.1073/pnas.1011900107.
Enlaces externos
- Esta obra contiene una traducción parcial derivada de «Amoeboid movement» de Wikipedia en inglés, publicada por sus editores bajo la Licencia de documentación libre de GNU y la Licencia Creative Commons Atribución-CompartirIgual 4.0 Internacional.