Nicotinamida adenina dinucleótido fosfato
La nicotinamida adenina dinucleótido fosfato (abreviada NADP+ en su forma oxidada y NADPH+H+ en su forma reducida) es una coenzima que interviene en numerosas vías anabólicas. Su estructura química contiene la vitamina B3 y es además análogo de la nicotinamida adenina dinucleótido (NADH+H+; NAD+ en su forma oxidada). Su fórmula empírica es C21H29N7O17P3.[2]
| Nicotinamida adenina dinucleótido fosfato | ||
|---|---|---|
 | ||
| General | ||
| Fórmula estructural |
 | |
| Fórmula molecular | ? | |
| Identificadores | ||
| Número CAS | 53-59-8[1] | |
| ChEBI | 25523 | |
| UNII | BY8P107XEP | |
El NADPH+H+ proporciona parte del poder reductor necesario para las reacciones de reducción de la biosíntesis.
Interviene en la fase oscura de la fotosíntesis (ciclo de Calvin), en la que se fija el dióxido de carbono (CO2); el NADPH+H+ se genera durante la fase luminosa.
Este cofactor es esencial tanto en reacciones anabólicas como catabólicas. Las rutas catabólicas suministran energía química en forma de ATP, NADH+H+, NADPH+H+ y FADH2.[3] Estos transportadores de energía se utilizan en las rutas anabólicas para convertir moléculas precursoras pequeñas en macromoléculas celulares. En los procesos anabólicos actúa como cofactor de las reductasas.
En los animales, la mayor fuente de NADPH+H+ es la fase oxidativa de la ruta de la pentosa fosfato, que produce 60% de los requerimientos de la célula.
Historia
La coenzima fue descubierta por el fisiólogo alemán Otto Heinrich Warburg en 1931 (Premio Nobel de Fisiología o Medicina en ese mismo año 1931) y también se conoció en la literatura especializada más antigua, hasta principios de la década de 1960, con el nombre de nucleótido de trifosfopiridina, abreviado TPN, o con los nombres de codehidrasa II o codehidrogenasa II o coenzima II.[4]
Biosíntesis
La molécula de NADP+ se produce a partir de una molécula de NAD+; este NAD+ parte del nicotinato, que es una molécula proveniente de las vitaminas de la alimentación (la vitamina B3, conocida como la vitamina niacina). Mediante una reacción, este es transformado en un nicotinatorribonucleótido, después en un desamido-NAD+, para acabar siéndole añadido un grupo amino de la cadena lateral de la glutamina y formar el NAD+.[5]
Una vez se ha obtenido la molécula de NAD+, su grupo 2-hidroxi de un anillo de ribosa puede ser fosforilado por una molécula de ATP, transformando así la molécula de NAD+ en NADP+.
Propiedades físicas y químicas
Esta coenzima experimenta reducción reversible del anillo de la nicotinamida. El NADP+ se reduce a NADPH+H+ aceptando un ion hidruro (dos electrones y un protón) a partir de un sustrato oxidable. El ion hidruro se puede adicionar en la parte frontal o posterior de la carga positiva del átomo del nitrógeno del anillo plano de la nicotinamida. El segundo protón eliminado del sustrato se libera al disolvente acuoso. La reacción es:
NADP+ + 2e- + 2H+ → NADPH + H+
El NADPH+H+ suele estar presente en concentración más elevada que su forma oxidada, NADP+. Esto favorece la transferencia de hidruro desde el NADPH+H+ a un sustrato. Se refleja así el papel metabólico especializado de esta coenzima, habitual en las reducciones de una reacción anabólica.
Las reacciones generales en las que actúa esta coenzima son:
A + NADPH + H+ → AH2 + NADP+ (donde AH2 es el sustrato reducido y A el sustrato oxidado.)
Cadena electrónica y fosforilación
Aunque sea un transportador electrónico, como el NADH+H+ o el FADH2, no suele ceder sus electrones y protones a la cadena respiratoria mitocondrial, sino que acostumbra a usar su poder reductor en las reacciones anabólicas para la síntesis de compuestos como los ácidos grasos, los esteroides,…
Excepcionalmente, puede transferir sus electrones a una molécula de NADH+H+ para que ésta trasfiera los electrones hacia la cadena respiratoria.
La reacción por la cual se rige esta transferencia de electrones es:
NADPH+H+ + NAD+ → NADP+ + NADH+H+
Ruta de las pentosas fosfato
Es una ruta metabólica estrechamente relacionada con la glucólisis durante la cual se utiliza la glucosa para generar ribosa, que es necesaria para la biosíntesis de nucleótidos y ácidos nucleicos.
La primera fase de la ruta de las pentosas fosfato consiste en dos oxidaciones que convierten la glucosa 6-fosfato en ribulosa 5-fosfato y reducen el NADP+ a NADPH+H+.
El NADPH+H+ formado en la fase oxidativa es utilizado para reducir glutatión (GSSG) y para sostener la biosíntesis de otras moléculas con su poder reductor. La ribosa 5-fosfato es un precursor para la síntesis de nucleótidos y ácidos nucleicos. Podemos decir que el producto esencial de la ruta de las pentosas fosfato no son las pentosas en sí, sino el dador electrónico NADPH+H+, necesario para las reacciones de reducción en la biosíntesis de otras moléculas.[6]
El que la glucosa 6-fosfato entre en la glucólisis o en la ruta de las pentosas fosfato depende de las necesidades momentáneas de la célula y de la concentración de NADP+ en el citoplasma. Cuando una célula está convirtiendo rápidamente NADPH+H+ en NADP+ en reducciones de biosíntesis, aumenta el nivel de NADP+ lo que estimula alostéricamente la G6PD (glucosa 6-fosfato deshidrogenasa), que es la enzima que empieza la primera reacción en la ruta de las pentosas fosfato. En cambio, cuando disminuye la demanda de NADPH+H+, la ruta de las pentosas se hace más lenta y la glucosa 6-fosfato se utiliza como combustible para la glucólisis.
Los tejidos que requieren el NADPH+H+ proporcionado por esta ruta son los que llevan a cabo activamente la síntesis de ácidos grasos (hígado, tejido adiposo, glándula mamaria lactante) o la síntesis de colesterol y hormonas esteroideas (gónada, glándulas adrenales).
En los eritrocitos, el NADPH+H+ producido por la vía de las pentosas fosfato es tan importante en la prevención de las lesiones oxidativas que un defecto genético en la glucosa 6-fosfato deshidrogenasa, la primera enzima de la vía, puede tener consecuencias médicas graves.
En las células que no utilizan ribosa 5-fosfato, la fase no oxidativa recicla seis moléculas de la pentosa en cinco moléculas de la hexosa glucosa 6-fosfato, lo que permite la producción continua de NADPH+H+ y convierte la glucosa 6-fosfato en CO2.
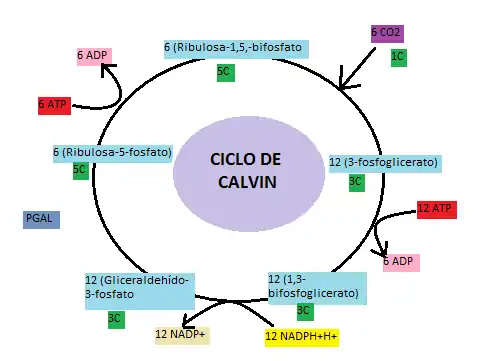
Ciclo de Calvin
El ciclo de Calvin se conoce como el conjunto de reacciones oscuras que se producen en el estroma del cloroplasto. Su función es la de fijar el dióxido de carbono atmosférico en los hidratos de carbono, utilizando la energía del ATP y el NADPH+H+ generados en las reacciones luminosas. El ciclo da lugar a la formación de hexosas y a la regeneración de la molécula aceptora. Este conjunto de reacciones bioquímicas tienen como resultado el aprovechamiento energético (azúcares) y constante para sintetizar ATP.[7]
En concreto el NADP+ en este ciclo actúa como agente reductor entre el 1,3-bisfosfoglicerato y el gliceraldehido-3-fosfato, juntamente con la pérdida de un fosfato. La reacción es catalizada por la enzima glicaraldehido-3-fosfato deshidrogenasa.
Aspectos de interés
La mayoría de las coenzimas provienen de sustancias denominadas vitaminas. El anillo tipo pirimidina del NADP+ proviene de la vitamina niacina. La carencia de niacina, que afecta a todas las deshidrogenasas dependientes del NADP+, es la causante de la grave enfermedad de la pelagra (del italiano “piel rugosa”).[8]
Proviene por una insuficiencia en la dieta, se encuentra con bastante frecuencia entre los alcohólicos o los que beben cantidades excesivas de alcohol. Esta enfermedad se caracteriza por dermatitis, diarrea y demencia, seguidas en muchos casos por la muerte.
Referencias
- Número CAS
- Westheimer, F.H., Why nature chose phosphates, Science 235, 1173-1178 (1987).
- Hanukoglu I (2017). «Conservation of the Enzyme-Coenzyme Interfaces in FAD and NADP Binding Adrenodoxin Reductase-A Ubiquitous Enzyme». Journal of Molecular Evolution 85 (5): 205-218. PMID 29177972. doi:10.1007/s00239-017-9821-9.
- Entrada de Nicotinamid-Adenin-Dinucleotid. en: Römpp's Chemistry Lexicon Römpp Online. Georg Thieme Verlag, consultado el 31 de mayo de 2021.
- Werner Müller-Esterl. Bioquímica. Fundamentos para Medicina y Ciencias de la Vida. Barcelona: Editorial Reverté, S. A., 2008. ISBN 978-84-291-7393-2
- C. K. Mathews, K. E. van Holde, K. G. Ahern. Bioquímica, tercera edición. Madrid: Pearson Educacion, S. A., 2002. ISBN 84-7829-053-2
- L. Stryer, J. M. Berg, J. L. Tymoczko. Bioquímica; sexta edición. Barcelona: Editorial Reverté, S. A., 2008. ISBN 978-84-291-7600-1
- Pitche P (2005). "Pellagra". Sante 15 (3): 205–8. PMID 1620758
Véase también
- Nicotinamida adenina dinucleótido (NAD+, NADH), molécula similar usada principalmente en las reacciones catabólicas.
[[Categoría:Alemania en 1931