Neurofarmacología
La Neurofarmacología es el estudio de como las drogas afectan la función celular en el sistema nerviosos, y los mecanismos neuronales en los que influye el comportamiento. Existen dos ramas principales de la neurofarmacología: conductual y molecular. La neurofarmacología conductual se enfoca en el estudio de como las drogas afectan el comportamiento humano (neuropsicofarmacología), incluyendo el estudio de cómo la dependencia y la adicción a las drogas afectan al cerebro humano.[1] La neurofarmacología molecular involucra el estudio de las neuronas y sus interacciones neuroquímicas, con el propósito principal de desarrollar drogas que tengan efectos benéficos en la función neurológica. Ambos campos están estrechamente relacionados, ya que ambos se preocupan por las interacciones de los neurotransmisores, neuropéptidos, neurohormonas, neuromoduladores, enzimas, segundos mensajeros, cotransportadores, canales iónicos, y receptores de proteínas en el sistema nervioso central y en el sistema nervioso periférico. Estudiando estas interacciones, los investigadores están desarrollando drogas para tratar muchos desórdenes neurológicos, incluyendo dolor, enfermedades neurodegenerativas como la enfermedad de Parkinson y la enfermedad de Alzheimer, desórdenes psicológicos, adicción, entre otras.
Historia
La neurofarmacología no apareció en el campo científico hasta que, a principios del siglo XX, los científicos fueron capaces de entender las bases del sistema nervioso y cómo los nervios se comunicaban entre ellos. Antes de éste descubrimiento, se habían encontrado drogas que demostraban algún tipo de influencia en el sistema nervioso. En los años de 1930s, científicos franceses comenzaron a trabajar con un compuesto llamado phenothiazine con la esperanza de sintetizar una droga que pudiera combatir la malaria. Sin embargo, esta droga mostró pocas esperanzas en el uso contra los individuos infectados con malaria, se encontró que tenía efectos sedantes con lo que parecían efectos benéficos hacia pacientes con la enfermedad de Parkinson. Este método de caja negra, en donde un investigador debe de administrar una droga y examinar la respuesta sin saber cómo relacionar la acción de la droga con la respuesta del paciente, era el principal acercamiento a este campo, hasta que, a finales de 1940 y principios de los 1950, los científicos eran capaces de identificar los neurotransmisores como la norepinefrina (involucrada en la contracción de los vasos sanguíneos y el incremento en la velocidad cardiaca y la presión sanguínea), dopamina (la sustancia cuya escasez está presente en la enfermedad de Parkinson), serotonina (reconocida como profundamente relacionada con la depresión). En 1950s, los científicos también pudieron ser capaces de medir mejor los niveles de neuroquímicos específicos en el cuerpo y por tanto, correlacionar estos niveles con el comportamiento.[2] La invención de la fijación de voltaje en 1949 permitió el estudio de los canales iónicos y el potencial de acción del nervio. Estos dos principales acontecimientos históricos en la neurofarmacología permitió a los científicos no solo estudiar cómo la información es transmitida de una neurona a otra, también, permitió estudiar el cómo una neurona procesa esta información dentro de ella.
Información general
La neurofarmacología es un amplio campo de la ciencia que engloba muchos aspectos del sistema nervioso desde la manipulación de una simple neurona hasta áreas enteras del cerebro, medula espinal, y nervios periféricos. Para un mejor entendimiento de las bases del desarrollo de una droga, primero se necesita entender cómo se comunican las neuronas entre ellas. Este artículo se enfocará tanto en la neurofarmacología conductual como en la molecular; los principales receptores, canales iónicos, y neurotransmisores manipulados por la acción de la droga y como personas con desórdenes neurológicos son beneficiados con la acción de la droga.
Interacciones neuroquímicas
Para entender los avances potenciales en medicina que la neurofarmacología puede traer, es importante entender como el comportamiento humano y los procesos del pensamiento son transferidos de neurona a neurona, y como los medicamentos pueden alterar las bases químicas de estos procesos.
Las neuronas son conocidas como células excitables porque en la superficie de su membrana hay una abundante cantidad de proteínas conocidas como canales iónicos que permiten el paso de pequeñas partículas cargadas hacia dentro y fuera de la célula. La estructura de la neurona permite recibir información química por sus dendritas, propagada a través del soma (cuerpo de la neurona) y por su axón, y eventualmente pasando a la otra neurona a través de su axón terminal.
 Estos canales iónicos dependientes de voltaje permiten una despolarización rápida en la célula. Esta despolarización, si alcanza cierto umbral, provocará un potencial de acción. Una vez que el potencial de acción alcanza el axón terminal, va a provocar la entrada de los iones de calcio hacia dentro de la célula. Los iones de calcio van a generar vesículas, pequeños paquetes llenos de neurotransmisores, para fusionarse con la membrana celular y liberar su contenido en el espacio sináptico. Esta célula es llamada neurona pre-sináptica, y la célula que interactúa con los neurotransmisores liberados se le conoce como neurona post-sináptica. Una vez que el neurotransmisor es liberado para la sinapsis puede: unirse a los receptores en la célula post-sináptica, la célula pre-sináptica puede tomarlo de nuevo para una transmisión posterior del mismo, o puede ser degradado por enzimas específicas a algunos neurotransmisores en el espacio sináptico. Estas tres diferentes acciones son en las que la acción de las drogas pueden principalmente afectar la comunicación entre neuronas.[2]
Estos canales iónicos dependientes de voltaje permiten una despolarización rápida en la célula. Esta despolarización, si alcanza cierto umbral, provocará un potencial de acción. Una vez que el potencial de acción alcanza el axón terminal, va a provocar la entrada de los iones de calcio hacia dentro de la célula. Los iones de calcio van a generar vesículas, pequeños paquetes llenos de neurotransmisores, para fusionarse con la membrana celular y liberar su contenido en el espacio sináptico. Esta célula es llamada neurona pre-sináptica, y la célula que interactúa con los neurotransmisores liberados se le conoce como neurona post-sináptica. Una vez que el neurotransmisor es liberado para la sinapsis puede: unirse a los receptores en la célula post-sináptica, la célula pre-sináptica puede tomarlo de nuevo para una transmisión posterior del mismo, o puede ser degradado por enzimas específicas a algunos neurotransmisores en el espacio sináptico. Estas tres diferentes acciones son en las que la acción de las drogas pueden principalmente afectar la comunicación entre neuronas.[2]
Hay dos tipos de receptores con los que los neurotransmisores interaccionan en la neurona post-sináptica. El primer tipo de receptores son los canales iónicos activados por ligando o LGICs (por sus siglas en inglés). Los receptores LGIC son los tipos de transducción de una señal química a una señal eléctrica más rápidos que existen. Una vez que el neurotransmisor se une al receptor, este va a causar un cambio conformacional que permitirá que los iones fluyan directamente hacia dentro de la célula. El segundo tipo de receptores, también conocidos como receptores acoplados a proteína G o GPCRs. Estos son mucho más lentos que los LGICs debido a que la cantidad de reacciones bioquímicas que beben hacerse en el espacio intracelular aumenta. Cuando el neurotransmisor se une a la proteína GPCR, provoca una cascada de interacciones intracelulares que pueden derivar en muchos diferentes tipos de cambios en la célula como los bioquímicos, fisiológicos, y de expresión genética. Las interacciones neurotransmisor/receptor en el campo de la neurofarmacología son bastante importantes porque muchas drogas que son desarrolladas hoy en día tienen que ver con la disrupción de este proceso de unión.[3]
Neurofarmacología molecular
La neuropharmacología molecular involucra el estudio de las neuronas, sus interacciones neuroquímicas, y los receptores en ellas, con el propósito de desarrollar nuevos medicamentos o drogas que puedan tratar desórdenes neurológicos como dolor, enfermedades neurodegenerativas, y desórdenes psicológicos (también llamado en este caso neuropsicofarmacología). Hay algunas palabras técnicas que deben de ser definidas para relacionar la neurotransmición con la acción del receptor:
- Agonista - una molécula que se une al receptor proteico y activa a dicho receptor.
- Antagonista competitivo - una molécula que se une al receptor proteico en el mismo sitio del agonista, previniendo la activación de ese receptor.
- Antagonista no competitivo - una molécula que se une al receptor proteico en un sitio diferente al sitio de unión del agonista, pero provoca un cambio conformacional en la proteína que no permite su activación.
Las siguientes interacciones neurotransmisor/receptor pueden ser afectadas por los componentes sinápticos que actúan como uno de los tres anteriores. Los canales de sodio/potasio también pueden ser manipulados en una neurona para inducir efectos de inhibición en los potenciales de acción.
GABA
El neurotransmisor GABA regula la inhibición rápida de la sinapsis en el sistema nervioso central. Cuando GABA es liberado de la célula pre-sináptica, se unirá al receptor (preferentemente en el receptor GABAA) que provoca la hiperpolarización de la célula post-sináptica (se queda por debajo de su umbral de acción potencial). Esto va a contrarrestar el efecto de cualquier manipulación exitatoria de las interacciones neurotransmisor/receptor.
Este receptor GABAA contiene muchos sitios de unión que permiten muchos cambios conformacionales y son el principal blanco del desarrollo de los medicamentos. El más común de estos sitios de unión, benzodiazepina, permite tanto a agonista como a antagonista tener efecto en el receptor. Un medicamento común, diazepam, actúa como un potenciador alostérico en este sitio de unión.[4] Otro receptor para GABA, conocido como GABAB, puede ser potenciado por una molécula llamada baclofen. Esta molécula actúa como un agonista, por lo tanto activa al receptor, y es conocido por ayudar al control y reducción del movimiento espástico.
Dopamina
El neurotransmisor de dopamina regula la transmisión sináptica al unir cinco GPCRs específicos. Estos cinco receptores proteicos se dividen en dos clases dependiendo de si su respuesta provoca una respuesta exitatoria o inhibitoria en la neurona post-sináptica. Hay muchos tipos de drogas, las legales y las ilegales, que afectan a la dopamina y a sus interacciones en el cerebro. La enfermedad de Parkinson, es una enfermedad que reduce la cantidad de dopamina en el cerebro, el precursor de la dopamina, Ledopa, es administrado al paciente debido al hecho de que la dopamina no puede atravesar la barrera hematoencefálica y L-dopa sí puede. Algunos agonistas de dopamina también son administrados a pacientes con Parkinson que tienen el desorden conocido como Síndrome de las piernas inquietas o RLS (por sus siglas en inglés). Algunos ejemplos de estos son ropinirol y pramipexole.[5]
Los desórdenes psicológicos como Trastorno por déficit de atención con hiperactividad (ADHD - siglas en inglés) puede ser tratado con drogas como methylphenidato (también conocido como Ritalin), que bloque el regreso de la dopamina a la neurona pre-sináptica, proporcionando de ese modo un incremento de la dopamina en el espacio sináptico. Este incremento en la dopamina sináptica va a incrementar los receptores de unión en la célula post-sináptica. Este mismo proceso es también usado en otras drogas ilegales como la cocaína.
Serotonina
El neurotransmisor de serotonina tiene la habilidad de regular la transmisión sináptica por medio de los receptores GPCR's o LGIC. Dependiendo de qué región del cerebro la serotonina actué, va a depender si su liberación incrementa o disminuye la respuesta de la neurona post-sináptica. Las drogas más populares y variadas en la regulación de serotonina en la depresión se les conoce como SSRI's (por sus siglas en inglés) o inhibidores selectivos de la recaptación de serotonina. Estas drogas inhiben el transporte de serotonina de regreso a la célula pre-sináptica, dejando más serotonina en el espacio sináptico para ser utilizada.
Antes del descubrimiento de los SSRI's había también muchas drogas que inhibían a la enzima que rompía la serotonina. MAOIs (siglas en inglés) o Inhibidores de la monoamino oxidasa incrementan la cantidad de serotonina en la célula pre-sináptica, pero tiene muchos efectos secundarios incluyendo intensas migrañas y presión arterial alta. Esto fue eventualmente ligado a la interacción de la droga con un químico llamado tyramina, la cual se encuentra en muchos tipos de comida.[6]
Canales iónicos
Los canales iónicos localizados en la superficie de membrana de la neurona permiten la entrada de los iones de sodio y la salida de los iones de potasio durante el potencial de acción. Bloquear selectivamente estos canales iónicos disminuirá la probabilidad de que el potencial de acción ocurra. La droga riluzol es una drupa neuroprotectora que bloquea los canales de los iones de sodio. Dado que estos canales no pueden ser activados, no hay potencial de acción, y la neurona no realizará ninguna transducción de señales químicas en señales eléctricas y la señal no se moverá. Esta droga es utilizada como anestésico así como un sedante.[7]
Neurofarmacología conductual
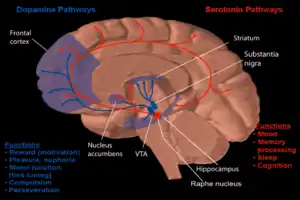
Una rama de la nuerofarmacología conductual se enfoca en el estudio de la dependencia a las drogas y como esta adicción a las drogas afectan a la mente humana. (ver neuropsicofarmacología para el comportamiento humano y el desarrollo de drogas) La mayoría de la investigación ha demostrado que gran parte del cerebro que refuerza la adicción por recompensa neuroquímica es el núcleo accumbens. La imagen de la derecha como dopamina y serotinina están protegidas en esta área. El abuso crónico del alcohol puede causar gran dependencia y adicción. Como esta adicción ocurre es descrita abajo.
Alcoholismo
Los efectos de comportamiento a causa del alcohol son principalmente producidos por su acción en el cerebro. La intoxicación es un resultado a corto plazo del alcohol presente en el cerebro que se le atribuye cambios en la comunicación neuronal. La tolerancia y la dependencia son efectos a largo plazo que involucra cambios moleculares y celulares a causa de la alta exposición del cerebro al alcohol. Investigadores han encontrado muchas áreas en el cerebro cuya función neuronal se ve afectada por la exposición crónica al alcohol. En el sistema GABAérgico, el receptor GABAA es modificado, afectando la eficiencia y el tiempo de la inhibición de la transmisión sináptica.[8] Esto también normalmente es acompañado por un aumento o decrecimiento en la liberación del neurotransmisor GABA causando que muchas neuronas en el cerebro se vuelvan hiperexitables durante la desintoxicación del alcohol. Dado que GABA, en la mayor parte, es un neurotransmisor inhibidor, un descenso en su cantidad resultará en un sentimiento de ansiedad.[3] Junto con GABA, ha habido otros enlaces con otros neurotransmisores que son afectados por el uso a largo plazo del alcohol, incluyendo dopamina, serotonina y glutamato.[7]
Investigación
Enfermedad de Parkinson
La enfermedad de Parkinson es una enfermedad neurodegenerativa descrita por la pérdida selectiva de neuronas dopaminergicas localizadas en la sustancia negra. Hoy en día, la droga más comúnmente utilizada para combatir esta enfermedad es Ledopa o L-DOPA. Este precursor de dopamina puede penetrar a través de la barrera hematoencefálica, mientras que el neurotransmisor dopamina, no puede. Ha habido una investigación intensiva para determinar si L-dopa es el mejor tratamiento para la enfermedad de Parkinson en lugar de otros agonistas de dopamina. Algunos piensan que el uso a largo plazo de L-dopa puede comprometer la neuroprotección y, por tanto, eventualmente deriva en la muerte de la célula dopaminergica. A pesar de que no ha habido pruebas, in-vivo o in-vitro, algunos aún creen que mientras más a largo plazo sea el uso de agonistas de dopamina, mejor será para el paciente.[9]
Enfermedad de Alzheimer
Dada la gran cantidad de hipótesis que han sido propuestas para la causa de la enfermedad de Alzheimer, el conocimiento de esta enfermedad está lejos de poder ser completamente explicado, haciendo difícil el desarrollo de métodos para su tratamiento. En el cerebro de los pacientes con Alzheimer, ambos receptores neurales nicotínicos de acetilcolina (nACh) y los receptores NMDA son conocidos por estar regulados. En consecuencia, cuatro acetilcolinesterasas han sido desarrolladas y aprobadas por la Administración de Alimentos y Medicamentos de Estados Unidos (FDA por sus siglas en inglés) para el tratamiento en E.U.A. Sin embargo, estas no son drogas ideales, considerando sus efectos secundarios y su efectividad limitada. Una droga prometedora, nefiracetam, está siendo desarrollada para el tratamiento de Alzheimer y otros pacientes con demencia, y tiene acciones únicas en potenciar la actividad de ambos receptores nACh y NMDA.[10]
Futuro
Con el crecimiento y desarrollo de la tecnología y nuestro entendimiento del sistema nervioso, el desarrollo de drogas continuará con un aumento en drogas más sensitivas y específicas. La relación estructura-actividad o SARs (por sus siglas en inglés) en la principal área de investigación en la neurofarmacología que trata de modificar el efecto o la potencia (i.e., actividad) de compuestos químicos bioactivos al modificar su estructura química.[7]
Referencias
- Everitt BJ, Robbins TW (2005). «Neural systems of reinforcement for drug addiction: from actions to habits to compulsion». Nature Neuroscience 8 (11): 1481-1489. doi:10.1038/nn1579. PMID 16251991.
- Wrobel S (2007). «Science, serotonin, and sadness: the biology of antidepressants: A series for the public». The FASEB Journal 21 (13): 3404. doi:10.1096/fj.07-1102ufm. PMID 17967927.
- Lovinger, D. M. (2008). «Communication Networks in the Brain Neurons, Receptors, Neurotransmitters, and Alcohol. [Review].». Alcohol Research & Health 31 (3): 196-214.
- Sigel E (2002). «Mapping of the benzodiazepine recognition site on GABA(A) receptors». Current Topics in Medicinal Chemistry 2 (8): 833-9. doi:10.2174/1568026023393444. PMID 12171574.
- Winkelman JW, Allen RP, Tenzer P, Hening W (2007). «Restless legs syndrome: nonpharmacologic and pharmacologic treatments». Geriatrics 62 (10): 6-13. PMID 17922563.
- López-Muñoz F, Alamo C (2009). «Monoaminergic neurotransmission: the history of the discovery of antidepressants from 1950s until today». Current pharmaceutical design 15 (14): 1563-1586. doi:10.2174/138161209788168001. PMID 19442174.
- Narahashi T (2000). «Neuroreceptors and ion channels as the basis for drug action: past, present, and future». The Journal of Pharmacology and Experimental Therapeutics 294: 1-26. PMID 10871290.
- Vengeliene V, Bilbao A, Molander A, Spanagel R (2008). «Neuropharmacology of alcohol addiction». British Journal of Pharmacology 154 (2): 299. doi:10.1038/bjp.2008.30. PMC 2442440. PMID 18311194.
- Shin JY, Park HJ, Ahn YH, Lee PH (2009). «Neuroprotective effect of l-dopa on dopaminergic neurons is comparable to pramipexol in MPTP-treated animal model of Parkinson’s disease: a direct comparison study». Journal of Neurochemistry 111 (4): 1042. doi:10.1111/j.1471-4159.2009.06381.x. PMID 19765187.
- Narahashi T, Marszalec W, Moriguchi S, Yeh JZ, Zhao X (2003). «Unique mechanism of action of Alzheimer's drugs on brain nicotinic acetylcholine receptors and NMDA receptors». Life Sciences 74 (2-3): 281-91. doi:10.1016/j.lfs.2003.09.015. PMID 14607256.