Nirsevimab
Nirsevimab es un medicamento indicado en la prevención de la infección por el virus sincitial respiratorio en lactantes y recién nacidos. Se comercializa con el nombre de Beyfortus. Fue aprobado para uso médico por la Agencia Europea de Medicamentos en noviembre de 2022. Es un anticuerpo monoclonal recombinante humano con actividad contra el virus sincitial respiratorio. Se administra en dosis única por vía intramuscular. Los efectos secundarios más comunes notificados son erupción cutánea, fiebre e hinchazón en el punto de inyección.[1][2][3][4]
| Nirsevimab | ||
|---|---|---|
| Identificadores | ||
| Número CAS | 1989556-22-0 | |
| Código ATC | No adjudicado | |
| Código ATCvet | No adjudicado | |
| PubChem | 384585358 | |
| DrugBank | DB16258 | |
| Datos químicos | ||
| Fórmula | C6494H10060N1708O2050S46 | |
| Datos clínicos | ||
| Nombre comercial | Beyfortus | |
| Estado legal | Necesita prescripción médica. | |
| Vías de adm. | Intramuscular | |
Indicaciones
Está indicado en la prevención de la enfermedad pulmonar grave causada por el virus sincitial respiratorio en niños recién nacidos y lactantes.[4]
La mayor parte de los niños de dos años ya han tenido una infección por el virus sincitial respiratorio, lo que causa entre 160 000 y 600 000 muertes al año a nivel mundial. Se calcula que entre el 25% y el 40% de los lactantes y niños presentan bronquiolitis o neumonía en su primer contacto con el virus.[5] [6]
Mecanismo de acción
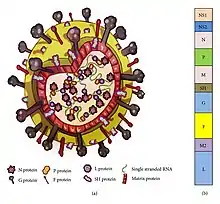
El nirsevimab se une de manera específica a la proteína F presente en la superficie del virus, impidiendo de esta forma que penetre en las células humanas. La proteína F, también llamada proteína de fusión, es una glicoproteína que puede encontrarse en dos estados: proteína F prefusión, antes de que el virus infecte la célula, y proteína F posfusión, que es la conformación que adquiere la proteína cuando entra en contacto con la célula humana y facilita la entrada del virus en la célula. [4] [7]
Dosis y vía de administración
Se administra mediante inyección única por vía intramuscular. La dosis recomendada es 50 mg para niños de menos de 5 kg de peso y 100 mg para los que tengan 5 kg o más. La concentración máxima en sangre se alcanza por término medio 6 días después de la administración.[4]
Eliminación
Se comporta como un anticuerpo monoclonal típico, por lo que se elimina mediante catabolismo celular, no existe evidencia de aclaramiento renal o hepático.[4]
Efectos secundarios
Los efectos secundarios observados con más frecuencia son erupción en la piel en las primeras dos semanas tras la administración del fármaco, fiebre y dolor e hinchazón en el punto de inyección.[4]
Investigación
Se han realizado diferentes ensayos clínicos para evaluar la eficacia y seguridad del medicamento:[8]
- Evaluación de la eficacia y seguridad del nirsevimab en niños sanos nacidos a término y prematuros en China (CHIMES).[9]
- Estudio para evaluar la seguridad y eficacia de MEDI8897 para la prevención de infecciones del tracto respiratorio inferior causadas por el virus sincitial respiratorio en niños sanos nacidos a término y prematuros (MELODY). Este ensayo recluto 1490 lactantes, de los cuales 994 fueron asignados al grupo que recibió tratamiento con nirsevimab y 496 al placebo. En los 150 primeros días tras la administración se produjo infección del tracto respiratorio inferior asociada al virus sincitial respiratorio en 12 lactantes (1,2%) en el grupo de nirsevimab y en 25 lactantes (5,0%) en el grupo de placebo.[10]
- Evaluación de la eficacia y seguridad del nirsevimab en niños con inmunodeficiencia (MUSIC).[11]
Véase también
Referencias
- «Nirsevimab demonstrated protection against respiratory syncytial virus disease in healthy infants in Phase 3 trial». Sanofi. 26 de abril de 2021. Archivado desde el original el 27 de diciembre de 2021. Consultado el 20 de noviembre de 2022.
- «Nirsevimab MELODY Phase III trial met primary endpoint of reducing RSV lower respiratory tract infections in healthy infants». AstraZeneca. 26 de abril de 2021. Archivado desde el original el 26 de diciembre de 2021. Consultado el 29 de noviembre de 2022.
- «Beyfortus approved in the EU for the prevention of RSV lower respiratory tract disease in infants». AstraZeneca. 4 de noviembre de 2022. Consultado el 6 de noviembre de 2022.
- European Medicines Agency. Beyfortus (nirsevimab)
- Recent Advances in Diagnosis, Prevention, and Treatment of Human Respiratory Syncytial Virus. Avances in Virology. Autores: Swapnil Subhash Bawage, Pooja Munnilal Tiwari, Shreekumar Pillai, Vida Dennis, and Shree Ram Singh.
- L. R. Krilov, “Respiratory syncytial virus disease: update on treatment and prevention,” Expert Review of Anti-Infective Therapy, vol. 9, no. 1, pp. 27–32, 2011.
- Avances en la prevención de la infección por el Virus Respiratorio Sincitial. Asociación Española de Pediatría. Consultado el 20 de noviembre de 2022.
- Ensayo MELODY fase 3. Nota de prensa Sanofi. Consultado el 25 de noviembre de 2022.
- Evaluate the Safety and Efficacy of Nirsevimab in Healthy Preterm and Term Infants in China (CHIMES).
- A Study to Evaluate the Safety and Efficacy of MEDI8897 for the Prevention of Medically Attended Lower Respiratory Tract Infection Due to Respiratory Syncytial Virus in Healthy Late Preterm and Term Infants (MELODY).
- Evaluate the Safety and Tolerability, for Nirsevimab in Immunocompromised Children (MUSIC).