Nitrometano
El nitrometano es un compuesto orgánico de fórmula química CH3NO2. Es el nitrocompuesto o nitroderivado más simple. Similar en muchos aspectos al nitroetano, el nitrometano es un líquido ligeramente viscoso, altamente polar, utilizado comúnmente como disolvente en muchas aplicaciones industriales, como en las extracciones, como medio de reacción, y como disolvente de limpieza. Como producto intermedio en la síntesis orgánica, se utiliza ampliamente en la fabricación de productos farmacéuticos, plaguicidas, explosivos, fibras, y recubrimientos. También se utiliza como combustible en coches de carreras modificados para sufrir grandes aceleraciones (dragsters), y en motores de combustión interna usados para coches en miniatura, por ejemplo, en los modelos de radio-control.
| Nitrometano | ||
|---|---|---|
 | ||
 | ||
| Nombre IUPAC | ||
| Nitrometano | ||
| General | ||
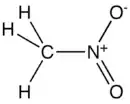
| Fórmula estructural | CH3-NO2 | |
| Fórmula molecular | CH3NO2 | |
| Identificadores | ||
| Número CAS | 75-52-5[1] | |
| Número RTECS | PA9800000 | |
| ChEBI | 77701 | |
| ChEMBL | CHEMBL276924 | |
| ChemSpider | 6135 | |
| PubChem | 6375 | |
| UNII | RU5WG8C3F4 | |
| KEGG | C19275 | |
| Propiedades físicas | ||
| Apariencia | incoloro | |
| Densidad | 1137,1 kg/m³; 11 371 g/cm³ | |
| Masa molar | 61,04 g/mol g/mol | |
| Punto de fusión | 244,15 K (−29 °C) | |
| Punto de ebullición | 375 K (102 °C) | |
| Temperatura crítica | 588 K (315 °C) | |
| Presión crítica | 5,9 MPa atm | |
| Viscosidad | 0,61 mPa·s a 25 °C | |
| Índice de refracción (nD) | 1,379 | |
| Propiedades químicas | ||
| Acidez | 10,2 pKa | |
| Solubilidad en agua | 10 g/100 mL a 20 °C (aprox.) | |
| Momento dipolar | 3,46 Debye D | |
| Termoquímica | ||
| ΔfH0gas | -81 kJ/mol | |
| ΔfH0líquido | -113 kJ/mol | |
| Capacidad calorífica (C) | 106 J/mol·K | |
| Peligrosidad | ||
| Punto de inflamabilidad | 308 K (35 °C) | |
| NFPA 704 |
3
2
4
| |
| Temperatura de autoignición | 690 K (417 °C) | |
| Frases R | R5 R10 R22 | |
| Frases S | S41 | |
| Límites de explosividad | 7,3-60% | |
| Riesgos | ||
| Riesgos principales | Inflamable, Nocivo | |
| Más información | Ficha de seguridad en fishersci.com (Inglés) | |
| Compuestos relacionados | ||
| nitrocompuesto | nitroetano | |
| Otros |
nitrito de metilo nitrato de metilo | |
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. | ||
Preparación
El nitrometano se produce industrialmente por tratamiento de propano con ácido nítrico a 350-450 °C. Esta reacción exotérmica produce industrialmente cuatro nitroalcanos significativos: nitrometano, nitroetano, 1-nitropropano, y 2-nitropropano. En esta reacción intervienen radicales libres, incluyendo radicales alcoxilo como el CH3-CH2-CH2-O·, que surgen a través de homólisis del correspondiente nitrito éster. Estos radicales alcoxi son susceptibles de sufrir reacciones de fragmentación del enlace C-C, lo que explica la formación de una mezcla de productos.[2] nitrometano
Aunque está disponible a un precio económico, el nitrometano se puede preparar por otros métodos que son de valor didáctico. La reacción de cloroacetato de sodio con nitrito de sodio en solución acuosa produce este compuesto:
- ClCH2-COONa + NaNO2 + H2O → CH3NO2 + NaCl + NaHCO3
Usos
El uso principal del nitrometano es como estabilizador de disolventes clorados, que se utilizan en la limpieza en seco, procesado de semiconductores, y desengrasado. También se utiliza con gran eficacia como disolvente o agente de disolución de monómeros de acrilato, como cianoacrilatos (más comúnmente conocido como "super glue").[2]
También se emplea como un componente de la mezcla combustible que usan los minimotores tipo "glow" de los vehículos de radiocontrol. Está constituido en su mayor parte de metanol, aceite y nitrometano. La presencia de nitrometano asegura un ralentí más estable y una mayor potencia, ya que contribuye a una mejor combustión de la mezcla. El porcentaje de nitrometano en la mezcla oscila del 5 al 25% (motores de dos tiempos), o del 10 al 30% (motores de 4 tiempos).[3]
Derivados
En síntesis orgánica, el nitrometano se emplea como un bloque de construcción de cadenas carbonadas. Su acidez le permite someterse a desprotonación, permitiendo reacciones de condensación análogas a las de los compuestos de carbonilo.
Así pues, mediante catálisis básica, el nitrometano se adiciona a aldehídos según una adición-1,2 en la reacción de Henry. Algunos derivados importantes son los plaguicidas cloropicrina, Cl3C-NO2 y tris(hidroximetil)nitrometano, (HOCH2)3C-NO2. La reducción de este último da tris(hidroximetil)aminometano, (CH2OH)3C-NH2, más conocido como "tris", un tampón muy usado.
En síntesis orgánica más especializada, el nitrometano sirve como donante de Michael, adicionándose a compuestos carbonílicos α, β-insaturados a través de una adición-1,4 en la reacción de Michael.
Nitrometano como combustible de motores
En una aplicación de menor importancia, el nitrometano se utiliza como combustible de vehículos de carreras, en particular dragsters, así como de cohetes y aeromodelos, generalmente conocidos en este contexto como "nitro" o "Top Fuel". El contenido de oxígeno del nitrometano permite que se queme con mucho menos oxígeno atmosférico en comparación con otros hidrocarburos como la gasolina:
- 4 CH3NO2 + 3 O2 → 4 CO2 + 6 H2O + 2 N2
Para quemar un kilogramo de gasolina se necesitan 14,7 kg de aire, pero solo 1,7 kg de aire para un kilogramo de nitrometano. Ya que el cilindro de un motor solo puede contener una cantidad limitada de mezcla combustible-aire en cada ciclo, se podrá quemar 8,7 veces más nitrometano que gasolina en un solo ciclo. El nitrometano, sin embargo, tiene una menor densidad de energía: la gasolina proporciona alrededor de 42-44 MJ/kg, mientras que el nitrometano solo produce 11,3 MJ/kg. Este análisis indica que el nitrometano genera alrededor de 2,3 veces la potencia de la gasolina cuando se combina con una determinada cantidad de oxígeno.
El nitrometano también puede ser utilizado como monopropelente, es decir, un combustible que se quema sin oxígeno añadido. La siguiente ecuación describe este proceso:
- 4 CH3NO2→ 4 CO + 4 H2O + 2 H2 + 2 N2
El nitrometano tiene una velocidad de combustión laminar de aproximadamente 0,5 m/s, algo más alta que la gasolina, por lo que es adecuado para motores de alta velocidad. También tiene una temperatura de llama algo superior a 2400 °C. El elevado calor de vaporización de 0,56 MJ/kg, junto con el elevado flujo de combustible ofrece un significativo enfriamiento de la carga de entrada (aproximadamente el doble que para el metanol), dando lugar a temperaturas bastante bajas.
El nitrometano se utiliza generalmente con mezclas ricas de combustible/aire, ya que proporciona potencia, incluso en ausencia de oxígeno atmosférico. Cuando se utilizan mezclas con aire ricas en combustible, dos de los productos de combustión son el hidrógeno y el monóxido de carbono. Estos gases a menudo entran en ignición, a veces de modo espectacular, como las mezclas normalmente muy ricas de combustible todavía ardiendo que salen por los tubos de escape. Mezclas muy ricas son necesarias para reducir la temperatura de las partes calientes de la cámara de combustión para controlar la preignición y la detonación posterior. Los detalles operacionales dependen de la mezcla y de las características particulares del motor.
Una pequeña cantidad de hidracina mezclada con el nitrometano puede aumentar la potencia aún más. Con el nitrometano, la hidracina forma una sal explosiva que es de nuevo un monopropelente. Esta mezcla inestable plantea un peligro de seguridad grave.
En los combustibles para modelos de aviones y de coches, el ingrediente principal es generalmente metanol con algo de nitrometano (de 0% a 65%, pero rara vez se supera el 30% ya que el nitrometano es caro en comparación con el metanol) y un 10-20% de lubricantes (generalmente aceite de ricino y/o aceite sintético). Incluso cantidades moderadas de nitrometano tienden a aumentar la potencia generada por el motor (como el factor limitante es a menudo la entrada de aire), haciendo el motor más fácil de ajustar (ajuste de la relación adecuado aire/combustible).
Propiedades explosivas
El nitrometano no fue conocido por ser un alto explosivo hasta que un vagón cisterna de ferrocarril cargado estalló el 1 de junio de 1958.[4] Después de muchas pruebas se comprobó que el nitrometano era un explosivo más enérgico que el TNT, aunque TNT tiene una mayor velocidad de la detonación y viveza.
Estos dos explosivos son pobres en oxígeno y algunos de sus beneficios se obtienen de la mezcla con un oxidante, como el nitrato de amonio. El nitrometano puro es un explosivo insensible con una velocidad de detonación de aproximadamente 6.200 m/s, pero aun así se pueden utilizar inhibidores para reducir los riesgos. La explosión del vagón cisterna se especuló que se debió a la compresión adiabática, un peligro común a todos los explosivos líquidos. Esto es, cuando las pequeñas burbujas de aire atrapadas se comprimen y se recalientan con rápidos aumentos de presión. Se pensaba que un operador rápidamente cerraba una válvula creando aumento de la presión del "martillo de bloqueo" . El nitrometano puede sensibilizarse mediante la adición de una base para elevar el pH.
El nitrometano también puede mezclarse con nitrato de amonio, utilizado como oxidante, para formar una mezcla explosiva conocida como ANNM. Un ejemplo gráfico de esto fue la utilización de nitrometano y nitrato de amonio en el atentado terrorista del Edificio Federal Alfred P. Murrah de Oklahoma City. También es miscible con ácido nítrico concentrado, formando una composición explosiva con una potencia y sensibilidad similares a la nitroglicerina.
Purificación
El nitrometano es un popular disolvente usado en química orgánica y electroanalítica. Puede ser purificado mediante enfriamiento por debajo de su punto de congelación, lavando el sólido con éter dietílico frío, seguida de destilación.[5]
Véase también
Referencias
- Número CAS
- Sheldon B. Markofsky “Nitro Compounds, Aliphatic” Ullmann's Encyclopedia of Industrial Chemistry, Wiley-VCH, Weinheim, 2002. doi 10.1002/14356007.a17_401.
- Tipos de combustible para radiocontrol. Archivado el 10 de enero de 2012 en Wayback Machine..
- Archivado el 7 de enero de 2009 en Wayback Machine."Interstate Commerce Commission: Ex Parte No 213. “Accident Near Mt. Pulaski, ILL”
- Coetzee, J. F. and Chang, T. H. (1986). «Recommended Methods for the Purification of Solvents and Tests for Impurities: Nitromethane» (PDF). Pure Appl. Chem. 58: 1541-1545. doi:10.1351/pac198658111541.
