Nitroxilo
El nitroxilo es un compuesto químico con la fórmula HNO. Es bien sabido en la fase gaseosa.[2] En solución acuosa actúa como un ácido con la base conjugada NO−, (pKa = 11.4).[3] NO− es la forma reducida del óxido nítrico (NO) y es isoelectrónico con dioxígeno. En nitroxilo puede formarse con un intermediario de reacción.
El nitroxilo es muy reactivo hacia nucleófilos (especialmente tioles) y rápidamente dimeriza al ácido hiponitroso, H2N2O2, que luego se deshidrata a óxido nitroso N2O. Por lo tanto, el HNO es generalmente preparado in situ por ejemplo, con los compuestos como sal de Angeli (Na2N2O3) y ácido Piloty (PhSO2NHOH) cuando sea necesario.
| Nitroxilo | ||
|---|---|---|
 | ||
| Fórmula molecular | ? | |
| Identificadores | ||
| Número CAS | 14332-28-6[1] | |
| ChEBI | 84879 | |
| ChemSpider | 920 | |
| PubChem | 945 | |
| UNII | GFQ4MMS07W | |
| Propiedades físicas | ||
| Masa molar | 31,006 g/mol | |
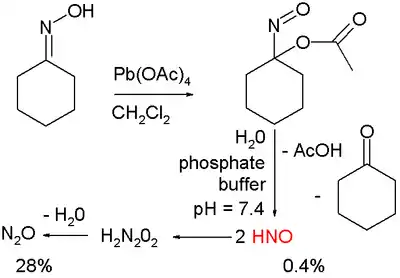
El nitroxilo muestra potencial en el tratamiento de la insuficiencia cardiaca y la investigación en curso se centra en la búsqueda de nuevos donantes nitroxilo. En un estudio,[4] donantes, se preparan por oxidación orgánica de la oxima ciclohexanona con tetraacetato de plomo para acetato nitrosociclohexilo 1:
Este compuesto puede ser hidrolizado en las condiciones en un tampón fosfato a nitroxilo HNO, ácido acético y ciclohexanona.
Otros estudios que se han realizado sobre los precursores en HNO incluyen los de Nagasawa et al.[5] en el que el ácido Piloty es derivatizado y produce la descomposición térmica del HNO. Otros estudios notables sobre la producción de HNO provienen del Toscano et al.[6] en el que especies de cicloaducto de acil (que se sabe que se descomponen por hidrólisis de HNO y ácido acilo) se sintetizan. Sobre fotólisis estos compuestos liberan especies acilo que luego se descomponen más.
Para más información remitirse al libro "The Chemistry and Biology of Nitroxyl".[7]
Referencias
- Número CAS
- Plantilla:Greenwood&Earnshaw
- Egon Wiberg, Arnold Frederick Holleman (2001) Inorganic Chemistry, Elsevier ISBN 0-12-352651-5
- Hydrolysis of Acyloxy Nitroso Compounds Yields Nitroxyl (HNO) Xin Sha, T. Scott Isbell, Rakesh P. Patel, Cynthia S. Day, and S. Bruce King J. Am. Chem. Soc.; 2006; 128(30) pp 9687 - 9692; (Article) doi 10.1021/ja062365a 10.1021/ja062365a
- Prodrugs of Nitroxyl as Potential Aldehyde Dehydrogenase Inhibitors vis-a-vis Vascular Smooth Muscle Relaxants Nagasawa, H. T.; Kawle, S. P.; Elberling, J. A.; DeMaster, E. G.; Fukuto, J. M. J. Med. Chem., 38, 1865-1871. doi 10.1021/jm00011a005
- Cohen, A. D.; Zeng, B.-B.; King, S. B.; Toscano, J. P. J. Am. Chem. Soc. 2003, 125, 1444-1445.doi 10.1021/ja028978e
- Doctorovich, Farmer, Martí (2016). 1. The Chemistry and Biology of Nitroxyl (HNO). Elsevier. ISBN 978-0-12-800934-5.
Enlaces externos
- Esta obra contiene una traducción derivada de «Nitroxyl» de Wikipedia en inglés, publicada por sus editores bajo la Licencia de documentación libre de GNU y la Licencia Creative Commons Atribución-CompartirIgual 4.0 Internacional.