Par de electrones
En química, un par de electrones (del inglés: Electron pair) o par de Lewis consiste en dos electrones que ocupan el mismo orbital molecular, pero que tienen espines opuestos.
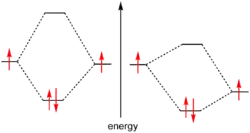
El concepto del par de electrones se introdujo en un artículo de Gilbert N. Lewis.[1]
Espines opuestos de los electrones del par
Debido a que los electrones son fermiones, el principio de exclusión de Pauli prohíbe a estas partículas tener exactamente iguales todos sus números cuánticos. Por lo tanto la única manera de ocupar el mismo orbital, es decir, tener iguales los mismos números cuánticos de orbital, es diferenciarse en el número cuántico de spin. Esto limita el número de electrones en el mismo orbital a solamente dos, cada uno de ellos con un valor distinto del número cuántico de espín (+1/2 ó -1/2 son los únicos valores posibles).[2]
El apareamiento de espines es a menudo energéticamente favorable y los pares de electrones por tanto desempeñan un papel muy importante en la química.
Tipos de pares de electrones
Los pares de electrones pueden:
- Formar un enlace químico entre dos átomos, es decir un par compartido: dos electrones comparten el espacio entre dos átomos unidos por un enlace covalente, ocupando un orbital molecular. Esta es la base de la teoría del enlace de valencia[2] desarrollada por Walter Heitler y Fritz London en 1927, o de la teoría del enlace por pares de electrones de Gilbert Newton Lewis.[3]
- Pertenecer a un par solitario, es decir un par no compartido, dos electrones que llenan un orbital atómico de un nivel de energía exterior de un átomo. Un par no compartido puede ser cedido a otro átomo actuando la especie donante como base de Lewis.[4][5]
- Llenar los niveles básicos de un átomo. Los electrones de niveles internos de un átomo no intervienen en los enlaces químicos que forma ese átomo, ni influyen en su reactividad química, pero igualmente están distribuidos en pares de electrones que ocupan orbitales atómicos.
Debido a que los espines están emparejados, y tienen sentido opuesto, el momento magnético total de los electrones se anula y la contribución de la pareja de electrones a las propiedades magnéticas en general será las de una sustancia diamagnética. Sólo habrá paramagnetismo si hay electrones desapareados.
Electrones no apareados
A pesar de que se puede observar en muchos ámbitos de la química una fuerte tendencia a la formación de pares de electrones, también es posible que en muchas especies químicas (átomos, moléculas o iones), los electrones aparezcan aislados en un orbital, como electrones no apareados, como es el caso de los radicales.
En el caso del enlace metálico los momentos magnéticos también se compensan en gran medida, pero el enlace es más comunitario por lo que los pares de electrones individuales no se pueden distinguir y es mejor considerar los electrones como un "océano" colectivo o formando parte de una banda de energía, más que formando parte de un orbital.
Superconductividad
Un caso muy especial de un par de electrones se produce en la explicación de la superconductividad que aporta la teoría BCS, desarrollada en 1957 por John Bardeen, Leon Cooper y Robert Schrieffer: la formación de pares de Cooper.[6]
Véase también
- Teoría de los pares de electrones del esqueleto poliédrico. (TPEEP)-(PSEPT)
Referencias
- Jean Maruani (1989). Molecules in Physics, Chemistry and Biology: v. 3: Electronic Structure and Chemical Reactivity. Springer. p. 73. ISBN 978-90-277-2598-1. Consultado el 14 de marzo de 2013.
- Química general: introducción a la química teórica. Cristóbal Valenzuela Calahorro. Universidad de Salamanca, 1995. ISBN 8474817838 Pág. 150
- Estructura atómica y enlace químico. Jaume Casabó i Gispert. Editorial Reverté, 1997. ISBN 8429171894 Pág. 99
- Química. American Chemical Society. Editorial Reverté, 2005. ISBN 8429170014 Pág. 366
- Valencia y estructura molecular. Edward Cartmell. Editorial Reverté, 2003. ISBN 842917091X Pág. 103
- Física para la ciencia y la tecnología. Paul Allen Tipler, Gene Mosca. Editorial Reverté, 2005. ISBN 8429144102 Pág. 166