Permanganato de sodio
El permanganato de sodio es un compuesto inorgánico de fórmula NaMnO4. Es la sal sódica del ácido permanganésico. En esta sal, el manganeso actúa con su mayor estado de oxidación, +7. El ion permanganato MnO4- actúa como un poderoso oxidante. Está estrechamente relacionado con el más común permanganato de potasio, pero en general es menos deseable, ya que es más caro de producir. Es principalmente disponible en forma de monohidrato. Esta sal absorbe agua de la atmósfera y tiene un punto de fusión bajo. Es casi 15 veces más soluble que KMnO4, por lo que el permanganato de sodio encuentra algunas aplicaciones donde se necesitan muy altas concentraciones de MnO4-.
| Permanganato de sodio | ||
|---|---|---|
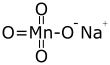 | ||
| Nombre IUPAC | ||
| Manganato (VII) de sodio | ||
| General | ||
| Otros nombres |
Permanganto de sodio Permanganto sódico | |
| Fórmula semidesarrollada | NaMnO4 | |
| Fórmula estructural |
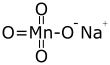 | |
| Fórmula molecular | ? | |
| Identificadores | ||
| Número CAS | 10101-50-5[1] | |
| Número RTECS | SD6650000 | |
| ChemSpider | 23303 | |
| PubChem | 23673458 | |
| UNII | IZ5356R281 | |
| Propiedades físicas | ||
| Apariencia | Sólido rojo | |
| Densidad | 2470 kg/m³; 2,47 g/cm³ | |
| Masa molar | 15 994 g/mol | |
| Propiedades químicas | ||
| Solubilidad en agua | Soluble | |
| Compuestos relacionados | ||
| Permanganatos | KMnO4 | |
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. | ||
Preparación y propiedades
El permanganato de sodio, no se puede preparar de forma análoga al KMnO4 porque no se forma la sal de manganato intermedia requerida, Na2MnO4. Por eso, se utilizan rutas menos directas incluida la conversión de KMnO4.[2]
El permanganato de sodio se comporta de manera similar al permanganato de potasio. Se disuelve fácilmente en agua para dar soluciones de color púrpura oscuro, la evaporación de los cuales da cristales prismáticos púrpura-negros brillantes del monohidrato NaMnO4 · H2O. La sal de potasio no forma un hidrato. Debido a su naturaleza higroscópica, es menos útil en química analítica que su homólogo de potasio.
Se puede preparar por la reacción de dióxido de manganeso con hipoclorito de sodio:
- 2 MnO2 + 3 NaClO + 2 NaOH → 2 NaMnO4 + 3 NaCl + H2O
Aplicaciones
Debido a su alta solubilidad, sus soluciones acuosas se utilizan como agentes de ataque en la fabricación de circuitos impresos.[2] Está ganando popularidad en el tratamiento del agua.
Referencias
- Número CAS
- Arno H. Reidies "Manganese Compounds" in Ullmann's Encyclopedia of Industrial Chemistry, 2002, Wiley-VCH, Weinheim. doi 10.1002/14356007.a16_123