Picrato de amonio
El picrato de amonio, también llamado explosivo D o dunnita, es un explosivo considerado seguro, pues requiere una substancial descarga eléctrica para ser detonado y es más seguro que el ácido pícrico.
| Picrato de amonio | ||
|---|---|---|
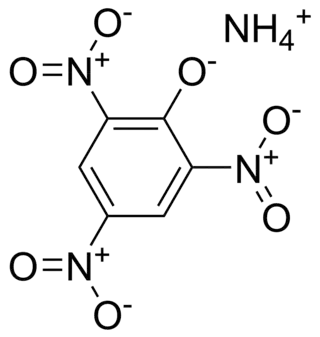 | ||
| Nombre IUPAC | ||
| Amonio 2,4,6-trinitrophenolato | ||
| General | ||
| Otros nombres | Dunnita, explosivo D | |
| Fórmula estructural | C6H6N4O7 | |
| Fórmula molecular | ? | |
| Identificadores | ||
| Número CAS | 131-74-8[1] | |
| Propiedades físicas | ||
| Densidad | 1719 kg/m³; 1,719 g/cm³ | |
| Masa molar | 246,13 g/mol | |
| Punto de fusión | 265 °C (538 K) | |
| Propiedades químicas | ||
| Solubilidad en agua | 10 g/L (20 °C) | |
| Peligrosidad | ||
| Frases R | R3 R23/24/25 | |
| Frases S | S1/2 S28 S35 S37 S45 | |
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. | ||
Desarrollado por el Mayor Dunn en 1906.[2] El picrato de amonio es una sal formada por reacción de ácido pícrico y amoniaco. Cabe señalar que el explosivo utilizado por primera vez en una operación de bombardeos aéreos en la historia militar, realizado por los pilotos italianos en Libia en 1911.[3] Fue muy utilizada por la Marina de los Estados Unidos durante la Primera Guerra Mundial.[4]
Aunque la dunnita se consideraba en general una sustancia insensible, en 1911 el ejército de Estados Unidos había abandonado a su uso en favor de otras alternativas.[5] La Armada de los Estados Unidos, sin embargo, lo siguió utilizando en proyectiles de artillería perforantes de blindaje y en la defensa costera. Normalmente no detonan en el impacto contra una coraza blindaje. Por el contrario, la granada puede atravesar el blindaje, tras lo cual la carga se detona por una espoleta de tiempo. Esto era un defecto que adolecián los primeros proyectiles perforantes, la carga detonaba por el impacto con el blindaje disipando la energía fuera del mismo.
Este es sencillo de elaborar teniendo ácido pícrico y amoníaco, ya que si se ponen los cristales de ácido pícrico en un contenedor de cristal y se disuelven en una gran cantidad de agua caliente, posteriormente agregando el amoníaco en exceso, y permitiendo que el exceso de amoníaco se evapore, el polvo sobrante deberá ser el picrato de amonio.
Véase también
Referencias
- Número CAS
- Dunnite Smashes Strongest Armor, The New York Times, August 18, 1907
- La Stampa , 2 de noviembre de 1911
- Dunnite, Firstworldwar.com
- Ridicule Spy Story: Army Abandoned the Use of Dunnite Years Ago, Officers Say, The New York Times, August 8, 1911