Pradera marina
Una pradera marina es un lecho marino poblado por plantas angiospermas, monocotiledóneas, perennes y rizomatosas, pertenecientes a una de las familias de monocotiledóneas que poseen representantes en hábitats estrictamente salinos (no salobres ni de agua dulce), en la mayor parte de los océanos del mundo: Zosteraceae, Posidoniaceae, Cymodoceaceae, algunos géneros de Hydrocharitaceae, y ocasionalmente Ruppiaceae.



Esta asociación de monocotiledóneas marinas es polifilético si se mantiene Hydrocharitaceae en él. En su definición filogenética, los pastos marinos comprenden todas estas familias salvo Hydrocharitaceae. Todas estas familias pertenecen al «clado acuático» del orden Alismatales en su circunscripción moderna (APG III, APWeb, flora global hasta géneros editada por Kubitzki (1998), etc.), en floras más antiguas pueden encontrarse ubicados en otros órdenes como Najadales o Hydrocharitales.[1]
Ecología
Las praderas marinas desempeñan un papel importante en los ecosistemas cerca de las riberas marinas de todos los continentes excepto en la Antártida.[2]
Las praderas submarinas
Estas curiosas plantas de flores submarinas son llamadas praderas o pastos, ya que sus hojas son largas y estrechas, verdes la mayor parte del tiempo, y porque estas plantas crecen a menudo bajo la forma de grandes praderas, que recuerdan a los pastos. En otras palabras, muchas de las praderas marinas semejan a primera vista a las gramíneas terrestres de la familia Poaceae.
Debido a que estas plantas deben hacer su fotosíntesis, están limitadas a no poder vivir más que sumergidas en la zona fótica, y la mayoría de estas plantas viven en las aguas costeras protegidas y poco profundas, enraizadas en la arena o el barro, a veces sobre el sustrato rocoso. La totalidad de su ciclo de vida, especialmente la polinización se lleva a cabo en el medio subacuático.
Las praderas a menudo poliespecíficas
Las praderas marinas forman extensas praderas que pueden ser monoespecíficas (formadas por una sola especie) o multiespecíficas (conviven varias especies).
Aproximadamente unas 70 especies han sido descritas en los mares del globo,[3] aunque la taxonomía de este grupo de plantas todavía se discute. Por ejemplo, Phillips y Menez (1988) sólo reconocen 48 especies.[4]
En las zonas templadas en general, un número restringido de especies dominan, o incluso una (como la zostera Zostera marina en el Atlántico Norte), mientras que los praderas tropicales son generalmente más diversas, con un máximo de 13 especies registradas en las islas Filipinas.[5] El Instituto Australiano de Ciencia Marina estima un total de 30 especies en todas las aguas de Australia.[6]
Las aguas del estrecho de Torres, al norte de Australia, acogen 11 especies.[7]
En el Mediterráneo, suman 5 especies Posidonia oceanica, Zostera marina, Zostera noltii, Cymodocea nodosa y Halophila stipulacea. Esta última es una especie del mar Rojo y del océano Índico, de reciente aparición en el Mediterráneo,[8] presumiblemente a través del canal de Suez, de donde le viene el nombre de «especies lesseptianas» a veces dado a una especie como resultado de esta migración, por analogía con Ferdinand de Lesseps promotor del canal.

Los ecosistemas muy ricos
Las praderas marinas son ecosistemas altamente diversificados y productivos. Pueden albergar cientos de especies asociadas pertenecientes a todas las phylums vivientes, por ejemplo peces juveniles y adultos, algas epifitas o algas libres macroscópicas o microscópicas, moluscos, vers poliquetos y nematodos. Pocas especies se consideraron originalmente que se alimentaban directamente de las hojas de los pastos marinos, en parte debido a su contenido nutricional bajo, pero algunas publicaciones científicas y la mejora de los métodos de trabajo han demostrado que los herbívoros marinos son un eslabón muy importante en la cadena alimentaria, con cientos de especies que se alimentan de pastos marinos de los océanos del mundo, incluyendo en especial los dugongos, los manatíes, peces, gansos, cisnes, erizos y cangrejos.
Las praderas marinas son a veces llamadas «ingenieros de ecosistemas», debido a que crean en parte sus propios hábitat: las hojas ralentizan las corrientes, aumentando la sedimentación; las raíces y los rizomas estabilizan el sustrato del fondo marino. Su importancia para las especies asociadas se debe principalmente a la provisión de abrigo (a través de su estructura en tres dimensiones en la columna de agua), y la tasa extraordinariamente alta de producción primaria.[9] Como resultado, las praderas marinas proporcionan a las zonas costeras una serie de bienes y servicios de los ecosistemas, también conocidos como servicios ecológicos; por ejemplo: el enriquecimiento de las zonas de pesca, la protección mecánica contra las olas y que limita la erosión costera, la producción de dioxígeno.
Las praderas marinas también contienen una gran variedad de vertebrados e invertebrados, así como moluscos, corales entre otros.
Utilización
Las praderas marinas son recolectadas como fertilizante para mejorar los suelos arenosos. Esta fue una actividad importante en la ría de Aveiro, Portugal, donde las plantas recolectadas se llamaron moliço.[10] A principios del siglo XX, las plantas que integran los pastos marinos se han utilizado en especial en Francia[11] a modo de relleno de colchón[12] y fueron muy apreciadas por las fuerzas francesas durante la Primera Guerra Mundial. Recientemente las plantas se han utilizado en muebles y tejidos, como el ratán.
Perturbaciones y amenazas
Factores perturbantes
Las perturbaciones naturales como el pasto de los herbívoros, las tormentas, los daños causados por el hielo y la desecación son parte integrante de la dinámica de los ecosistemas marinos. Las praderas marinas presentan un alto grado de plasticidad fenotípica, adaptándose rápidamente a las cambiantes condiciones ambientales. Las praderas marinas, sin embargo, están disminuyendo en general, con unos 30 000 km² perdidos en las últimas décadas.[cita requerida] La principal razón de este descenso es la perturbación causada por el hombre, incluida la eutrofización, la destrucción mecánica del hábitat y la sobrepesca. El aporte excesivo de nutrientes (nitrógeno, fósforo) es directamente tóxico para las praderas marinas, pero más grave, estimula el crecimiento de las epifitas y las algas flotantes macroscópicas y microscópicas. Esto se traduce en una disminución en la cantidad de luz solar que puede llegar a las hojas de las plantas, lo que reduce su fotosíntesis y por ello su producción primaria. La descomposición de los tallos de las algas, así como el aceite de algas conduce a la proliferación de algas (bloom), dando un efecto retroactivo (feedback) positivo. Esto puede conducir a una reorganización completa del ecosistema que puede pasar de un predominio de las praderas marinas a una dominancia de las algas.
La sobrepesca de grandes peces depredadores puede aumentar indirectamente el crecimiento de algas, reduciendo así la regulación que permite el pasto de los invertebrados herbívoros, tales como los crustáceos y los gasterópodos, por un fenómeno de cascada trófica.[13]
Por último, la introducción de nuevas especies, como la Caulerpa taxifolia también puede tener un impacto negativo sobre la diversidad de las praderas marinas.
Medidas de protección
Los métodos más comunes utilizados para proteger y restaurar las praderas marinas incluyen la reducción de los niveles de nutrientes y de la contaminación, la conservación mediante el uso de áreas marinas protegidas y la restauración mediante el trasplante de llanuras de praderas marinas.
El gobernador del estado de Florida cuyas aguas albergan 7 especies[14][15] de estos magnoliophytes marinos[16] ha promulgado una carta de sensibilización de la protección de las praderas marinas, «Seagrass Awareness Month».[17]
Taxonomía
Lista de géneros
En 1970, Cornelis den Hartog[18] clasificó las plantas marinas en dos familias:
- familia de Potamogetonaceae
- familia de Hydrocharitaceae
Aunque algunos autores respecto a esta clasificación en dos familias,[19] el Catálogo de la Vida 2009[20] excluye las plantas de las Potamogetonaceae que componen las praderas marina para clasificarlas en tres familias: Zosteraceae, Posidoniaceae y Cymodoceaceae.
La clasificación, pues, incluyó 12 géneros repartidos en 4 familias:
.jpg.webp)
- Familia de Zosteraceae
- 1 Zostera
- 2 Phyllospadix
- 3 Heterozostera
- 1 Zostera
- Familia de Posidoniaceae
- Familia de Cymodoceaceae
- 5 Halodule
- 6 Cymodocea
- 7 Syringodium
- 8 Thalassodendron
- 9 Amphibolis
- 5 Halodule
- Familia de Hydrocharitaceae
Recientemente, se han añadido otras dos familias a esta lista, porque además de contener otras plantas de agua dulce, los géneros han dado raras especies de afinidad marina.[2] Estas familias pertenecen, al igual que las otras 4, al orden de las Najadales según la clasificación clásica:
- Familia de Ruppiaceae
- 13 Ruppia
- 13 Ruppia
- Familia de Zannichelliaceae
- 14 Lepilaena
- 14 Lepilaena
Sin embargo, su clasificación como plantas marinas se discute.[21] De acuerdo con Maureen L. Sullivan:
[...] ¿Cuales son las condiciones "artificiales" necesarias para concluir que una planta es marina? Fue Arber, quién en 1920,[22] dio, por primera vez, los cuatro criterios esenciales.
(I) La planta debe crecer en un ambiente salado (marino) [...],
12 (primeros) géneros mencionados anteriormente cumplen todos estos requisitos. Otros cinco géneros de plantas, Zannichellia, Lepilaena, Althenia, Ruppia, y algunas especies de Potamogeton, también parecen satisfacer estas exigencias, pero, el hecho de que estas plantas crezcan sobre todo en aguas salobres, y toleren una amplia gama de salinidad, no las hacen verdaderamente marinas.
(Ii) su modo de crecimiento debe de se totalmente sumergido,
(Iii) deberá ser capaz de anclarse para resistir la acción de las mareas,
(Iv) por último, debe ser capaz de llevar a cabo su ciclo de vida completamente sumergida, en particular su polinización (polinización hidrófila).
Los[...] quelles sont les conditions "artificielles" nécessaires pour conclure qu'une plante est marine ? C'est Arber qui, en 1920, en a, pour la première fois, donné les quatre critères essentiels.
(i) La plante doit croitre en milieu salé (marin), [...],
(ii) son mode de croissance doit être complètement immergé,
(iii) elle doit être en mesure de s'ancrer pour bien résister à l'action des marées,
(iv) enfin, elle doit être en mesure de mener son cycle de vie entièrement immergée notamment sa pollinisation (pollinisation hydrophile).
Les 12 (premiers) genres nommés ci-dessus satisfont à toutes ces exigences. Cinq autres genres de plantes, Zannichellia, Lepilaena, Althenia, Ruppia, et certaines espèces de Potamogeton, semblent satisfaire aussi à ces exigences, mais, du fait que ces plantes croissent principalement en eau saumâtre, et tolèrent une large gamme de salinité, elles ne sont pas véritablement marines.Maureen L. Sullivan
De hecho, para definir las especies realmente marinas, un quinto criterio fue propuesto por den Hartog y Kuo:[2] la baja tolerancia a las variaciones de la salinidad hacen una especie estrictamente marina. En otras palabras, las especies marinas son estenohalinas, a diferencia de las especies estrictamente marinas que son, ellas mismos, eurihalinas.
Clave de identificación
En 1970 C. den Hartog propuso la siguiente clave dicotómica de identificación de 12 géneros de «praderas marinas».[18] Su principal valor reside en el hecho de que se basa en criterios morfológicos de las partes estériles de las plantas, con la exclusión de facto de criterios relativos a los órganos reproductivos (flores). Es una clave no ligada a la clasificación filogenética de los géneros y sus relaciones, por lo que, a pesar de las modificaciones en la clasificación del clado, no ha quedado obsoleta.
En la clave que sigue, el número de la izquierda se refiere al número de la sección anterior «lista de géneros»:
- I) Hoja con lígula.
- II) Existencia de células de taninos.
- III) Rizomas monopodiales, plantas herbáceas, con brotes laterales pequeños.
La vaina de la hoja persiste más que la propia hoja.- IV) Rizoma muy grueso, produciendo brotes rastreros laterales ocasionales.
Debajo de cada grupo de hojas aparecen vainas hirsutas que se asemejan a restos de paja.
El final de las hojas es truncado o abultado, no dentado...................................................4 Posidonia - IV) Final del rizoma con un tallo corto en cada extremo.
Las hojas apicales son de forma diferente (bífidas, dentadas o puntiagudas).- V) Hojas aplanadas
- VI) 3 nervaduras.....................................................................................................................................................................5 Halodule (=Diplanthera)
- VI) 7 a 17 nervaduras.............................................................................................................................................................6 Cymodocea
- V) Hojas que terminan en punta (subuladas) ...............................................................................................................................7 Syringodium
- V) Hojas aplanadas
- IV) Rizoma muy grueso, produciendo brotes rastreros laterales ocasionales.
- III) Rizomas simpodiales, leñosos, con brotes verticales alargados.
Lámina de la hoja tumbada, con su vaina.- VII) Rizomas con uno o dos tallos, poco ramificados, cada 5 internodos, o sin ramificar.
Raíces en cada nodo precedente a la emergencia de los tallos.
Hojas con venas paralelas y dentículos obtusos en los ápices........................................................................8 Thalassodendron - VII) Rizomas con una o dos raíces en cada internodo y un tallo extremadamente ramificado a intervalos de 4-8 internodos.
Hojas con nervadura pseudoparalela, enteras, con el ápice bidentado u obtuso.................................................................................9 Amphibolis
- VII) Rizomas con uno o dos tallos, poco ramificados, cada 5 internodos, o sin ramificar.
- III) Rizomas monopodiales, plantas herbáceas, con brotes laterales pequeños.
- II) Sin células productoras de taninos
- VIII) Rizomas monopodiales, herbáceas, con pequeñas yemas laterales en cada nodo y dos cordones vasculares
- IX) Rizomas con internodos alargados y una o dos raíces finas y largas en cada nudo.
Limbo foliar fino, traslúcido de bordes enteros o, raramente, ligeramente dentado.
Vaina de la hoja caduca, aunque a veces permanece sobre esta vaina una parte basal escamosa.................................1 Zostera - IX) Rizomas con internodos cortos y dos o más raíces cortas y espesas en cada internodo
Limbo foliar coriáceo, bordeado de pequeñas células.
La parte basal de la vaina se deshace con el tiempo en paquetes de fibras finas lanosas..................................2 Phyllospadix
- IX) Rizomas con internodos alargados y una o dos raíces finas y largas en cada nudo.
- VIII) Rizomas simpodiales, leñosos, con yemas que no se aparecen en cada nodo.
De 4 a 12 cordones vasculares en la superficie......................................................................3 Heterozostera
- VIII) Rizomas monopodiales, herbáceas, con pequeñas yemas laterales en cada nodo y dos cordones vasculares
- II) Existencia de células de taninos.
- I) Hoja sin lígula
- X) Hojas pareadas o en pseudoverticilos, diferenciadas en un peciolo y un limbo.
Limbo oval, elíptico, lanceolado o lineal.......................................................12 Halophila - X) Hojas no diferenciadas en peciolo y limbo. Dísticas, oblongo-lineales o lineales.
- XI) Rizomas con una yema dispuesta lateralmente en cada extremidad.
De 10 a 20 pares de hojas oblongo-lineales, sésiles y denticuladas denticulées................12 Halophila spinulosa - XI) Rizomas espesos de los que parten de vez en cuando tallos laterales provistos de una larga hoja en cinta.
- XII) Rizomas de, al menos, un centímetro de diámetro, cubiertos de colgajos negros y fibrosos.
Raíces similares a cuerdas.
Hojas de 12,5 a 17,5 mm de longitud large...............................................................................10 Enhalus - XII) Rizomas con al menos 0,5 cm de diámetro, con raíces finas.
Internodos con surcos longitudinales y una yema en cada extremo.
Hojas de 0,5 a 1 cm de largo.............................................................................11 Thalassia
- XII) Rizomas de, al menos, un centímetro de diámetro, cubiertos de colgajos negros y fibrosos.
- XI) Rizomas con una yema dispuesta lateralmente en cada extremidad.
- X) Hojas pareadas o en pseudoverticilos, diferenciadas en un peciolo y un limbo.
Ancestros Magnoliophytes marinas
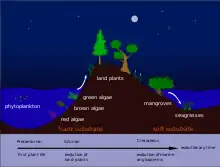
Fósiles difíciles de estudiar
El origen de Magnoliophytes marinas aún es poco conocido. Sus fósiles son extremadamente raros y muy difíciles de interpretar. Algunos descubrimientos han sido erróneamente atribuidas a este grupo de plantas.[2] En particular Archeozostera descubiertos en terrenos cretácicos de Japón han demostrado no sólo no ser Magnoliophyta sino ni siquiera ser los restos fósiles de una planta. Del mismo modo, Thalassocharis pertenecientes al cretácico de Westfalia (Alemania) y de Maastricht (Países Bajos) tampoco serían los restos fósiles de una planta acuática.
El único género cuyo origen cretácico está confirmado es la Posidonia, con:
- Posidonia cretacea Hosius y von der Mark
- Posidonia parisiensis (Brongniart) Fritel
- Posidonia perforata de Saporta & Marion[23]
Otro tipo de fósiles del Maastrichtiense (Cretácico Superior), Thalassotaenia ha sido estudiado.[24] Este género podría ser el ancestro del clado Cymodoceaceae-Posidoniaceae-Ruppiaceae.
Se han descubierto otros fósiles en los suelos más recientes del Eoceno de Avon Park (Florida):
- Thalassodendron auricula-leporis den Hartog
- Cymodocea floridana den Hartog
- Thalassia testudinum
En los depósitos marinos del Mioceno de Célebes se han recolectado fósiles en buen estado de conservación de Cymodocea serrulata atribuidos a la especie Cymodocea micheloti Wat.
Las plantas de origen múltiple
Las Magnoliophytas marinas se han formado a partir de plantas terrestres que se han adaptado poco a poco al medio marino. La diversidad de estas plantas ha llevado a la hipótesis de que la transición que las ha llevado desde el medio terrestre al marino puede haber ocurrido en diferentes períodos geológicos según las especies. Un estudio filogenético ha llevado a la conclusión de que tres linajes han hecho de forma independiente este pasaje:[25]
- Zosteraceae,
- el complejo Cymodoceaceae compuesto por Posidoniaceae, Cymodoceaceae y Ruppiaceae,
- Hydrocharitaceae.
Véase también
Notas y referencias
- (en francés) «Boudouresque C.F. Structure et fonctionnement des écosystèmes benthiques marins. Introduction générale. Marseille, COM, 80 p.». 2009. Archivado desde el original el 29 de diciembre de 2009. Consultado el 7 de diciembre de 2009.
- den Hartog, C.; Kuo, J.; Larkum, A.W.D.; Orth, R. J.; Duarte, C. M. (2006). Seagrasses: Biology, Ecology and Conservation. Taxonomy and Biogeography of Seagrasses (en inglés). Dordrecht (The Netherlands): Springer. p. 1-23. ISBN 1-4020-2942-X.
- (en inglés) «Catalogue of Life». El catálogo 2009 tiene 67 especies: Cymodoceaceae (16), Hydrocharitaceae (16), Posidoniaceae (9) et Zosteraceae (27).
- (en inglés) Phillips R.C and Menez E.G. Seagrasses. Washington D.C., Smithsonian Institution Press, 1988, 116p.
- (en inglés) «Steffen S. Bach et al.1998. Species composition and plant performance of mixed seagrass beds along a siltation gradient at Cape Bolinao, The Philippines». Pag. 248 «Les communautés mixtes d'herbiers du Sud-Est de l'Asie comptent jusqu'à 13 espèces...»"
- (en inglés) «Seagrasses. AIMS Research, 2008». Archivado desde el original el 28 de octubre de 2009. « Over 30 species can be found within Australian waters.»
- Seagrass-Watch. «Torres Strait Seagrass communities». Consultado el 23 de febrero de 2010. «Torres Strait has been described as the most extensive, ecologically complex shelf in the world... Eleven species of seagrass have been recorded in the Strait providing a relatively diverse array of species. »
- (en francés) Collectif. Guide des algues des mers d'Europe [Algues et Phanérogames marines], Paris, Delachaux et Niestlé, 1992: 231 p. ISBN 2-603-00848-X.
- (en francés) Collectif. Préservation et conservation des herbiers à Posidonia oceanica. Accord RAMOGE, 2006, ISBN|2-905540-30-3 «Rapport RAMOGE2006». Archivado desde el original el 16 de mayo de 2011. Consultado el 4 de abril de 2010. Pag. 27: Cette production primaire [celle des Magnoliophytes marines] est comparable ou supérieure aux autres milieux à forte production, qu'ils soient terrestres [...] ou océaniques [...].
- (en francés) «The seaweed resources of Portugal». Pag. 6. El «moliço» es una mezcla de algas y hierbas marinas recolectadas en la ría de Aveiro.
- (en francés) Paul Gloess. Les Plantes marines. Leurs utilisations. Bull. Inst. Océanogr. No 350, Mónaco, 1919.
- (en francés) Collectif. op.cit., pag. 62.
- «cascade trophique». Archivado desde el original el 30 de enero de 2010. Consultado el 4 de abril de 2010.
- (en inglés) Judson Parker (14 de marzo de 2010). «Paying tribute to Florida's seagrasses». Tallahassee Environmental News Examiner. Archivado desde el original el 6 de abril de 2010. Consultado el 18 de marzo de 2010.
- (en inglés) Florida Oceanographic Coastal Center (Florida Oceanographic Society) (2003). «Seagrasses of Florida». Archivado desde el original el 7 de enero de 2010. Consultado el 23 de marzo de 2010.
- Une espèce des genres Thalassia, Syringodium, Halodule, Ruppia, et 3 espèces du genre Halophila
- (en inglés) Charlie Crist, Governor (5 de marzo de 2010). «Seagrass Awareness Month». Consultado el 18 de marzo de 2010.
- den Hartog C. (1970). The Seagrasses of the World (en inglés) (1.ª edición). Ámsterdam: North Holland Publishing Company. p. 275.
- (en inglés) Phillips R.C and Menez E.G. op. cit.
- Catalogue of Life. Op. cit.
- Maureen L. Sullivan (diciembre de 1994). «The taxonomy of "seagrasses" surveyed from the higher taxa down through to the family level». Florida International University. Consultado el 13 de enero de 2010. «Amphibolis: (from the Greek amphibol - ambiguous) ».
- Arber, A. (1920). Water plants, a study of aquatic angiosperms (en inglés). Cambridge University Press. pp. 436.
- «Does the seagrass Posidonia really occur in Madagascar?». Phycologia (en inglés) 47 (4): 435-436. 2008. ISSN 0031-8884. (enlace roto disponible en Internet Archive; véase el historial, la primera versión y la última).
- van der Hama R.W.J.M., van Konijnenburg-van Citterta J.H.A. & Indeherbergec L. (mayo de 2007). «Seagrass foliage from the Maastrichtian type area (Maastrichtian, Danian, NE Belgium, SE Netherlands).». Review of Palaeobotany and Palynology. (en inglés) 144 (3-4): 301-321. ISSN 0034-6667. Consultado el 8 de marzo de 2010.
- Les D.H. et al (1997). «Phylogenic studies in Alismatida, II. Evolution of marine angiosperms (sea-grasses) ans hydrophily». Syst. Bot. (en inglés) 22: 443-463.
Bibliografía
- Duarte C.M. & Chiscano C.L. 1999. "Seagrass biomass and production: a reassessment". Aquatic Botany vol. 65, Issues 1-4: pag. 59-174.
- Green E.P. & Short F.T. 2003. World Atlas of Seagrasses. University of California Press, Berkeley, CA. 298 pag.
- den Hartog C. 1970. The Seagrasses of the World. Verhandl. der Koninklijke Nederlandse Akademie van Wetenschappen, Afd. Natuurkunde, No. 59 (1).
- Hemminga M.A. & Duarte C.M. 2000. Seagrass Ecology. Cambridge University Press, Cambridge. 298 pag.
- Hogarth P. 2007. The Biology of Mangroves and Seagrasses. Oxford University Press.
- Larkum A.W.D., Orth R.J. & Duarte C.M. 2007. Seagrasses: Biology, Ecology and Conservation Dordretch (The Netherlands), Springer, 2eme éd.: 691 pag.: Seagrasses
- Larkum A.W.D., Orth R.J. & Duarte C.M. Seagrass Biology: A Treatise. CRC Press, Boca Raton, FL, en prensa.
- Moffler M.D. & Durako M.J. Reproductive Biology of the Tropical-Subtropical Seagrasses of the Southeastern United States. Florida Department of Natural Resources. St-Petersburg (Florida), USA: 12p + biblio 1806 à 1985 Seagrasses SE-United States (enlace roto disponible en Internet Archive; véase el historial, la primera versión y la última).
- Orth R.J. et al. 2006. A Global Crisis for Seagrass Ecosystems. BioScience. vol. 56 No. 12 (December 2006): pag. 987-96.
- Schwartz A., Morrison M., Hawes I. & Halliday J. 2006. Physical and biological characteristics of a rare marine habitat: sub-tidal seagrass beds of offshore islands. Science for Conservation 269. 39 pp. Sub-tidal seagrass beds
- Short F.T. & Coles R.G. 2001. Global Seagrass Research Methods. Elsevier Science, Ámsterdam. 473 pag.
Enlaces externos
- (en inglés) «Seagrasses» del oeste de Australia
- (en inglés) Seagrass-Watch - el mayor seguimiento y diagnóstico científico no-destructivo de praderas marinas en el mundo
- (en inglés) Restore-A-Scar - una campaña no lucrativa para restaurar las praderas marinas dañadas por las anclas de barcos
- (en inglés) SeagrassNet - programa de reconocimiento global de praderas marinas
- (en inglés) Fundación para la protección de las praderas marinas
- (en inglés) Taxonomía de las Alismatales marinas (enlace roto disponible en Internet Archive; véase el historial, la primera versión y la última).
- (en inglés) World Seagrass Association
- (en inglés) Herbiers de Zostera marina de Long Island, Universidad de Cornell
- (en inglés) Gestión de praderas marinas en el mar de China y el golfo de Tailandia
- (en inglés) Marine Ecology, Vol.27-4, December 2006 - Numéro spécial «Advances in Seagrass Research».
- (en inglés) Praderas marinas de Camboya
- (en inglés) Seagrass 2000 - A mediterranean seagrass organization
- (en inglés) World wide seagrasses