Proteínas STAT
La familia de proteínas STAT (Signal Transducer and Activator of Transcription), son un grupo de proteínas que actúan principalmente como transductoras de señales y activadoras de la transcripción. [1] Participan en procesos de proliferación, inmunidad, apoptosis, y diferenciación celular.
Las STAT se encuentran en el citosol y una vez activadas por fosforilación, se desplazan al núcleo de la célula para realizar la transcripción genética de algunos genes.
En 2008 los investigadores, han descubierto que también hay proteínas STAT no fosforiladas (por lo tanto, que no han sido previamente activadas) que también llevan a cabo la transcripción, pero esta es una vía intrigante para los científicos, quienes no han hallado aún exactamente el mecanismo que usan estas proteínas para hacerlo.[2]
Las proteínas STAT fueron descubiertas en la década de los 90. Desde un principio ya se observó que eran fundamentales para la señalización de citocinas. Hoy en día, se conoce mucho más de esta familia de proteínas; estas participan en procesos de proliferación, inmunidad, apoptosis, y diferenciación celular.[3]
Hay siete proteínas dentro de la familia STAT, y todas ellas se observaron primero en ratones. Hoy en día se sabe que las contienen los mamíferos, pero, además, también se han encontrado en especies como Drosophila, Anopheles, Danio, Dictyostelium, Caenorhabditis elegans o Xiphophorus.
Los genes que codifican las proteínas STAT se han localizado en distintos cromosomas. La STAT 1 y STAT 4 se encuentran en el cromosoma 2; STAT 2 y STAT 6 en el cromosoma 12; las STAT 3 y STAT 5 a/b están en el cromosoma 17.[4]
Estructura
Encontramos siete genes en el genoma humano que codifican proteínas de la familia STAT (STAT1, STAT2, STAT3, STAT4, STAT5A, STAT5B y STAT6), aunque se han encontrado más proteínas que genes, concretamente, cinco más; esto es gracias a la proteólisis.
Se sabe que estas proteínas tienen un tamaño de 90-115 kDa, y que aproximadamente están compuestas de entre 700 y 850 aminoácidos.[5]

Algunas proteínas se juntan para formar dímeros. Para que las STAT puedan formarlos, el dominio Sr de homología 2, también conocido como SH2, se tienen que juntar con una fosfotirosina opuesta de una STAT diferente o de otra molécula. Esta fosfotirosina está muy conservada y la encontramos situada en la C-terminal.[1]
Dominios
Los dominios son regiones compactas localizadas dentro de las proteínas.[6] El dominio se pliega independientemente de la proteína, y se une a ella mediante un enlace peptídico.[7]
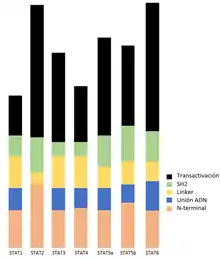
Algunos dominios son compartidos por las STAT con una alta homología. Comparten, concretamente, seis dominios, los cuales siguen este orden empezando por el amino terminal: dominio N-terminal, dominio ciled-coil, dominio de unión al ADN, dominio Linker, dominio SH2 y dominio de activación trascripcional.
- Dominio N-terminal o amino terminal: está conformado de aproximadamente 130 aminoácidos. Este dominio está muy implicado en interacciones entre proteínas, así como también en la desactivación de las STAT y en la translocación al núcleo. Se encuentra muy cerca del dominio donde se establece la unión al ADN.[1]
- Dominio de superenrrollamiento (ciled-coil): El dominio N-terminal y el dominio superenrollado están unidos mediante una cadena polipeptídica flexible. El dominio superenrollado está formado por cuatro hélices alfa, se encuentra en los aminoácidos 135-315. Este dominio está presente en la unión con el receptor, con la exportación nuclear y con la fosforilación en tirosina.[1]
- Dominio de unión al ADN: Este dominio se encuentra en los aminoácidos 320-480 y su conformación es un barril beta con un pliegue de inmunoglobulina[1]
- Dominio Linker: Este dominio está muy poco definido en cuanto a función, pero se sabe que mutaciones en dos de sus aminoácidos encontrados concretamente en la STAT de tipo 1, provocan la eliminación de la respuesta transcripcional del interferón gamma, o también conocido como INF-γ. Esta mutación no afecta al interferón alfa, conocido como INF-α. [1]
- Dominio SH2 y motivo de activación en tirosina (Tyr): Este dominio se encuentra entre los aminoácidos 580-680, y es el dominio mejor conservado. Está conformado en hojas beta colocadas de forma antiparalela rodeadas por dos hélices alfa, que forman un bolsillo. Tiene una importante función en la señalización, gracias a su competencia de unir fosfotirosinas encontradas en motivos de diferentes proteínas.[1] Mediante el dominio SH2, la STAT se une, a través de una proteína adaptadora o directamente, a las tirosinas fosforiladas del receptor cerca de las quinasas JAK ya activadas.[8]
- Dominio de activación transcripcional: Este dominio está localizado en el extremo C-terminal, o también conocido como carboxilo terminal, el cual, tiene unas isoformas truncadas que funcionan como reguladores dominantes negativos.[1] Una isoforma es una de las formas que puede adoptar una misma proteína. Estas isoformas se encuentran en las STAT3, STAT4 y STAT5[9]
Tipos de STAT
Las seis STAT tienen una función fundamental en la regulación del sistema inmunitario innato y adaptativo.[10] Por lo general todas tienen una estructura común, pero se ha visto que cada una tiene funciones específicas. Además también pueden distinguirse por el tipo factor, hormona o citocina que las activa.
- STAT1: Está regulada por IL-2 (interleucina 2), IL-6, IL-10, IFN-α (interferón alfa), IFN-β, IFN-γ, IL-27.[11] STAT1 tiene un papel clave en la expresión de genes relacionados con la supervivencia de la célula, viabilidad o respuesta a patógenos. Además se ha observado su influencia en cáncer y se ha demostrado que tiene tanto función pro-tumorgénica como supresora de tumores. Lo hace favoreciendo o no proliferación celular, así como activando o inhibiendo el sistema inmune.
- STAT2: Forma un complejo con la STAT 1 y Factor Regulador de Interferón 9 (IFN9), que incrementa la trascripción de genes en presencia de interferón (IFN-α, IFN-β).
- STAT3: Tiene multitud de funciones dentro de la célula: regula genes que forman parte de la división y el crecimiento de la célula (como por ejemplo, de las células que forman y destruyen el tejido óseo), así como también de su movimiento y de su apoptosis, es decir, la destrucción de la célula. Las STAT3 también envían señales para provocar la maduración de células inmunitarias, concretamente las T y las B; y también regulan la inflamación, que es un mecanismo de inmunidad innata, es decir, que se nace ya con él.[12]
- STAT4: Es un factor de transcripción que se une a varias zonas del genoma expresando, entre otros, genes promotores de genes para receptores y factores de señalización relacionados con componentes del sistema inmune. En concreto, es necesaria para la diferenciación de células Th (Linfocitos T helper) y para respuestas a IL12 (interleucina 12) en linfocitos.[13]
- STAT5: Hay dos proteínas: la STAT5A y STAT5B. Las dos tienen un papel fundamental en la activación de genes específicos de producción de tejido mamario (concretamente estimula la formación de epitelio mamario de secreción láctea). Además están implicadas en enfermedades hematológicas. En cuanto a su relación con tumores, no sabe demasiado aunque hay experimentos que sugieren que puede promover la respuesta inmune anti-tumor. También se ha visto que tienen papel activo en el crecimiento somático en respuesta a la hormona del crecimiento (GH-Growth Hormone).[14] Además de activarse con ésta, lo hacen en presencia de prolactina y tromboproteína.
- STAT6: Está regulada por IL4 e IL13 y tiene un papel fundamental en la respuesta inmune mediada por IL4 que permite la diferenciación de linfocitos T tipo 2. Así dicha proteína está muy implicada en la inmunidad adaptativa y en la respuesta antiviral. Además su expresión está relacionada con inflamación y una gran variedad de tumores, de modo que podría servir como un indicador clínico.[15]
Función
Las proteínas de la familia STAT, contienen en su estructura el dominio SH2. Este, se encuentra involucrado en los procesos de señalización, ya que es capaz de unir fosfotirosinas presentes en motivos específicos de otras proteínas.[16] Las fosfotirosinas son unos aminoácidos presentes en proteínas endógenas, relacionados con la transducción de la señal celular. El dominio SH2 participa entonces en el reclutamiento de las STATs al receptor de citocina. Permite también la asociación con las JAK activadas y la homo o heterodimerización de las STATs.[1]
Gracias a esto, las STAT funcionan como factores de transcripción celular, involucrados en diferentes procesos de desarrollo y función del sistema inmunológico. Desempeñan un papel importante también en procesos de crecimiento celular, apoptosis y diferenciación celular. Destacan por su papel en la tolerancia inmunológica y en la vigilancia de tumores.[17]
La técnica del gen knockout aportó mucha de la información sobre estas proteínas. Los ratones knockout para la STAT1 son más susceptibles a padecer infecciones virales o bacterianas, además de presentar alteraciones esqueléticas; la ausencia de la STAT2 también influye en la susceptibilidad de padecer infecciones virales; la pérdida de la STAT3 produce muerte embrionaria precoz. Esta proteína es importante también en la regulación de la respuesta inflamatoria, en el proceso de cicatrización de las heridas, y en el desarrollo mamario. El principal efecto de la ausencia de STAT4 es un deficiente desarrollo de linfocitos T helper tipo I. Las consecuencias de la deficiencia de proteínas STAT5A son fallos en el desarrollo mamario y en la lactación de ratones hembra, y la de la ausencia de las STAT5B es principalmente la disminución del crecimiento de ratones macho. Los ratones knockout para la proteína STAT6, presentan fallos en el desarrollo de linfocitos T helper tipo II.[18]
Activación
Las STAT se encuentran en el citosol, y, generalmente, requieren de una activación para desplazarse al núcleo de la célula para así realizar la transcripción de algunas secuencias genéticas. Pueden ser activadas por hormonas, factores de crecimiento o citocinas (siendo estas últimas las más comunes). Cada tipo de STAT tiene afinidad de ser activada por un tipo de citocina (o sustancia) o por otra; por lo tanto, la activación de cada uno de los tipos de esta familia de proteínas será un poco distinta. Aun así, todas se asemejan un poco, y es que para que una proteína STAT sea activada, se suele dar a cabo mediante su fosforilación. Una vez han sido fosforiladas por quinasas, se unen formando un dímero. Este dímero se traslada hasta el núcleo, donde empieza a transcribir secciones de ADN. Una vez ha acabado, las proteínas STAT se desfosforilan y son transportadas de nuevo al citosol.
- También se sabe que algunas proteínas STAT no necesitan ser fosforiladas: directamente viajan hasta el núcleo y transcriben ADN. Esta es una vía que se ha observado sobre todo en las STAT1 y STAT3.
| Proteína | Aminoácido que se fosforila |
|---|---|
| STAT I | Tirosina 701- Serina 727 |
| STAT II | Tirosina 689 |
| STAT III | Tirosina 705- Serina 727 |
| STAT IV | Tirosina 722- Serina 722 |
| STAT V a | Tirosina 694- Serina 726 |
| STAT V b | Tirosina 694- Serina 731 |
| STAT VI | Tirosina 641 |
Vía JAK-STAT
Artículo principal: "JAK-STAT pathway"
La vía de activación más conocida y particular de estas proteínas es la vía JAK-STAT, en la cual encontramos las proteínas JAK asociadas a un receptor de citocina. Cuando llega la señal de citocina, las proteínas JAK ("Janus kinase") son activadas. Una vez esto ha ocurrido, las proteínas JAK fosforilan las STAT. Las proteínas STAT, una vez fosforiladas forman homo o heterodímeros y se trasladan al núcleo. Allí se unen a un motivo de reconocimiento de ADN, llamado GAS y estimulan la expresión de los genes inducibles por citocinas. Esta vía está relacionada con la respuesta inflamatoria del sistema inmune.[1]
Referencias
- «Vía JAK/STAT: Una visión general». VERTIENTES: Revista Especializada en Ciencias de la Salud, 8. 2005.
- Yang, Jinbo; Stark, George R (25 de marzo de 2008). «Roles of unphosphorylated STATs in signaling». Cell Research (en inglés) 18 (4): 443-451. ISSN 1001-0602. doi:10.1038/cr.2008.41. Consultado el 18 de octubre de 2018.
- Lim, Cheh Peng; Cao, Xinmin (Noviembre de 2006). «Structure, function, and regulation of STAT proteins». Molecular bioSystems 2 (11): 536-550. ISSN 1742-206X. PMID 17216035. doi:10.1039/b606246f. Consultado el 18 de octubre de 2018.
- Calò, Valentina; Migliavacca, Manuela; Bazan, Viviana; Macaluso, Marcella; Buscemi, Maria; Gebbia, Nicola; Russo, Antonio (31 de julio de 2003). «STAT proteins: From normal control of cellular events to tumorigenesis». Journal of Cellular Physiology (en inglés) 197 (2): 157-168. ISSN 0021-9541. doi:10.1002/jcp.10364. Consultado el 20 de octubre de 2018.
- https://www.tesisenred.net/bitstream/handle/10803/325156/efmm1de1.pdf?sequence=1&isAllowed=y
- «Estructuras Supersecundarias (Motivos) y Dominios».
- «Concepto de dominio».
- Taleisnik, Samuel. Receptores Celulares y la Transducción de Señales. Temas de Biología Celular. p. 100.
- «Isoforma».
- EMBL-EBI, InterPro. «STAT transcription factor, protein interaction (IPR013799) < InterPro < EMBL-EBI». www.ebi.ac.uk (en inglés). Consultado el 20 de octubre de 2018.
- Gao, Bin; Wang, Hua; Lafdil, Fouad; Feng, Dechun (2012-8). «STAT proteins - key regulators of anti-viral responses, inflammation, and tumorigenesis in the liver». Journal of Hepatology 57 (2): 430-441. ISSN 0168-8278. PMC 3399024. PMID 22504331. doi:10.1016/j.jhep.2012.01.029. Consultado el 20 de octubre de 2018.
- «STAT3 gene».
- Database, GeneCards Human Gene. «STAT4 Gene - GeneCards | STAT4 Protein | STAT4 Antibody». www.genecards.org. Consultado el 20 de octubre de 2018.
- Varco-Merth, Ben; Rotwein, Peter (1 de noviembre de 2014). «Differential effects of STAT proteins on growth hormone-mediated IGF-I gene expression». American Journal of Physiology - Endocrinology and Metabolism 307 (9): E847-E855. ISSN 0193-1849. PMC 4216947. PMID 25205818. doi:10.1152/ajpendo.00324.2014. Consultado el 20 de octubre de 2018.
- Zhou, Xiang; Jiang, Zhengfan (2017-4). «N4 DNA recognition by STAT6: structural and functional implications». Protein & Cell 8 (4): 240-241. ISSN 1674-800X. PMC 5359187. PMID 28220394. doi:10.1007/s13238-017-0380-z. Consultado el 20 de octubre de 2018.
- Ó Mórdha, Séamus P. (1975). «Saothar Énrí Uí Mhuirgheasa». Clogher Record 3: 227-340. doi:10.2307/20641338. Consultado el 20 de octubre de 2018.
- Encyclopedia of Signaling Molecules. Springer International Publishing. 2018. pp. 4961-4961. ISBN 9783319671987. Consultado el 19 de octubre de 2018.
- Arce, Víctor M.; Catalina, Pablo F.; Mallo, Federico (2006). Endocrinología. Univ Santiago de Compostela. ISBN 9788497506229. Consultado el 19 de octubre de 2018.