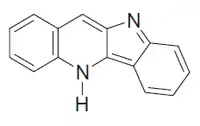
Quindolina
La quindolina es un compuesto tetraheterocíclico. Es un alcaloide aislado de las raíces de Cryptolepis sanguinolenta[2][3] (Asclepiadaceae, ubicada ahora como Apocynaceae). Este alcaloide es activo contra bacterias gram-positivas.[4]
| Quindolina | ||
|---|---|---|
 | ||
| Nombre IUPAC | ||
| 5H-Indolo[3,2-b]quinolina | ||
| General | ||
| Fórmula estructural |
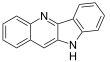 | |
| Fórmula molecular | C15H10N2 | |
| Identificadores | ||
| Número CAS | 243-58-3[1] | |
| ChEMBL | CHEMBL224248 | |
| PubChem | 98912 | |
| Propiedades físicas | ||
| Apariencia | Agujas (Etanol) | |
| Masa molar | 218,257 g/mol | |
| Punto de fusión | 187 °C (460 K) | |
| Punto de descomposición | 247 °C (520 K) | |
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. | ||
UV: [neutro]λmax228;276;344 ( MeOH) [acid]λmax226;272;286;368 ( MeOH/HCl). Presenta fluorescencia azul en solución. Sublima a presión de 1 atmósfera y 187 °C.
Derivados
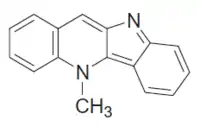
La 5-metil-5H-quindolina (Criptolepina; CAS 480-26-2, C16H12N2, PM 232.284) es un alcaloide también encontrado en Cryptolepis sanguinolenta. Es un compuesto con actividad antibacteriana, antiherpética, antimalárica y antihiperglicémica.[5] Es un inhibidor de la agregación de plaquetas.[6] También es activo contra bacterias gram-positivas. Forma agujas púrpura. Su punto de fusión se encuentra en el intervalo 175 - 178 °C, mientras que su monohidrato funde a 166-169 °C.
A continuación se muestran los datos espectroscópicos de la criptolepina:
- IR (KBr) νmax cm-1: 1644, 1615, 1466, 1354, 1308, 1242, 1031, 775, 715, 597
- EIMS (m/z) 232 [M]+ (100%), 217 (32), 190 (15), 116 (16), 102 (11), 94 (15), 89(35).
- 1H NMR (CD3OD) δppm: 8.91 (s, H-11), 8.54 (d, 8.5, H-4), 8.50 (d, 9.1, H-6), 8.34 (dd, 7.8, 1.2, H-l), 8.05 (ddd,8.5, 7.3, 1.2, H-3), 7.80 (dd, 7.8, 7.3, n-2), 7.74 (dd, 8.4, 1.3,n-9), 7.69 (dd, 8.4, 7.6, n-8), 7.34 (ddd, 9.1, 7.6, 1.3, H-7),4.95 (s, N-Me)[7]
La biscriptolepina (5,5′-Dimetil-11,11′-bi-5H-quindolina; CAS: 175178-79-7, PM 462.553, C32H22N4 ) es un dímero de la criptolepina aislado de la corteza de la raíz de Cryptolepis sanguinolenta. Es un polvo amorfo verde activo contra bacterias gram-positivas y micobacterias[8][9]
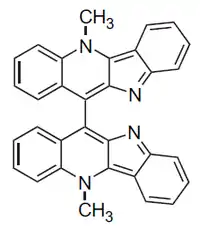
Síntesis
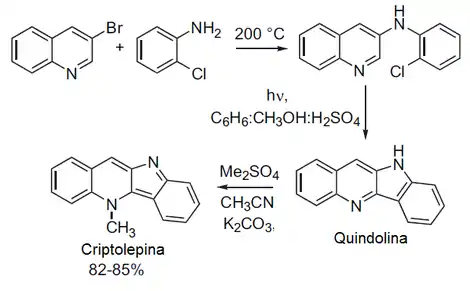
Fichter sintetizó por primera vez la quindolina en 1906.[10] Varios investigadores han propuesto métodos para sintetizar anillos de quindolina simples y sustituidos, tales como Armit,[11] Holt[12] y Radl.[13] Dhanabal y colaboradores desarrollaron un método en tres pasos para sintetizar quinolidina y criptolepina a partir de 3-bromoquinolina y o-cloroanilina. El producto forma la quinolidina por ciclización fotoquímica en presencia de yodo. Se obtiene la criptoleurina por metilación de la quinolidina con sulfato de metilo.[14]
Referencias
- Número CAS
- Gellert, E. et al., Helv. Chim. Acta, 1951, 34, 642- 651
- Dwuma-Badu, D. et al., J. Pharm. Sci., 1978, 67, 433- 434
- Oyekan, A.O. et al., Gen. Pharmacol., 1988, 19, 233- 237; 1993, 24, 461- 469; 1993, 24, 1285- 1290
- Oyekan, A.O. et al., J. Cardiovasc. Pharmacol., 1994, 23, 601- 611
- Cimanga, K. et al., J. Nat. Prod., 1997, 60, 688- 691
- Pousset et al. Phytochemistry (1995) 39(3): 735-736
- Cimanga, K. et al., Tet. Lett., 1996, 37, 1703- 1706
- Cimanga, K. et al., Phytomedicine, 1998, 5, 209- 214
- Fichter, F. et al., Ber., 1906, 39, 3932- 3942; 1910, 43, 3489- 3499
- Armit, J.N. et al., JCS, 1922, 121, 827- 839
- Holt, S.J. et al., JCS, 1947, 607- 611
- Radl, S. et al., J. Het. Chem., 2000, 37, 855- 862
- Dhanabal et al. Tetrahedron (2006) 62:6258–6263
_W2_IMG_3219.jpg.webp)