Reacción de Barton-McCombie
La reacción de Barton-McCombie (Llamada también Desoxigenación de Barton-McCombie) es una reacción orgánica en la que se sustituye el grupo hidroxilo de un alcohol por un hidrógeno de tal manera que se obtiene un alcano.[1][2]
Se llama así por los químicos británicos Derek Harold Richard Barton (1918-1998) y Stuart W. McCombie. En la reacción relacionada denominada descarboxilación de Barton, el reactivo inicial es un ácido carboxílico en lugar de un alcohol.
Mecanismo
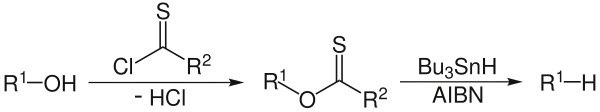
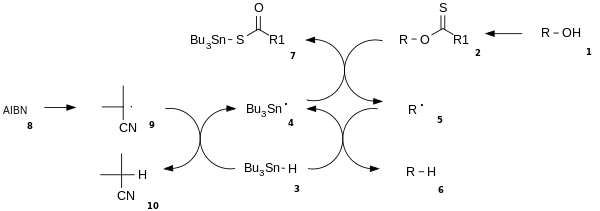
El mecanismo de reacción consiste en un paso de iniciación catalítica radical y un paso de propagación.[3] El alcohol (1) se convierte primero en un xantato (2). El azobisisobutironitrilo (AIBN) 8 descompone al hidruro de tributilestaño 3 en un radical de tributilestaño 4. El radical tributilestaño abstrae el grupo xantato de 2, obteniéndose un radical alquilo 5 y xantato de tributilestaño (7). El enlace del estaño con azufre de este compuesto es muy estable y proporciona la fuerza motriz de esta reacción. El radical alquilo formado abstrae a su vez un átomo de hidrógeno de una molécula nueva de hidruro de tributilestaño, formando el producto deseado (6) y un nuevo radical de tributil estaño disponible para la propagación.
Variaciones
Fuentes alternativas de hidruro
La principal desventaja de esta reacción es el uso del hidruro de estaño (El cual es muy tóxico, de alto costo y difícil de eliminar de la mezcla de reacción). Una alternativa es el uso de anhídrido de tributilestaño como la fuente de radicales y poli(metilhidrosiloxane)(PMHS) como fuente de hidruro.[4] Si se utilizan fenilclorotionoformatos en vez de xantatos se genera cloruro de carbonilo como subproducto de la reacción .
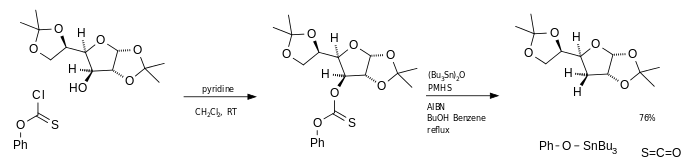
Trialquilboranos
Un donador de radicales hidrógeno aún más conveniente es proporcionado por los complejos de agua-trialquilborano [5][5] tales como trimetilborano contaminados con pequeñas cantidades de agua.
En este ciclo catalítico la reacción se inicia con la oxidación con aire del trialquilborano 3 para obtener el radical metilo 4. Este radical reacciona con el xantato 2 para obtenerse un S,S'-dimetilditiocarbonato (7) y el radical intermediario 5. El complejo (CH3)3B.H2O proporciona un hidrógeno para recombinar con este radical al alcano 6, dejando el ácido dietilborínico y un nuevo radical metilo.
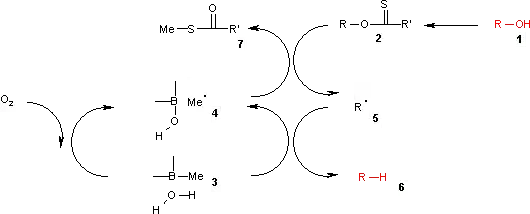
Se han realizado cálculos teóricos que muestran que una reacción de homólisis del hidroxilo en el complejo agua-borano es endotérmica, con una energía similar a la de la reacción de homólisis del hidruro de tributilestaño, pero mucho menor que la reacción homólisis de agua pura.
Aplicaciones
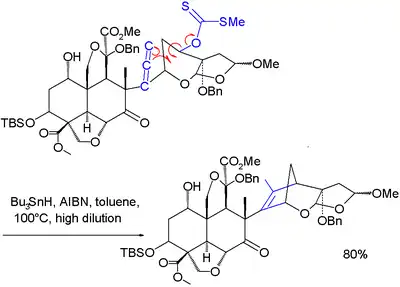
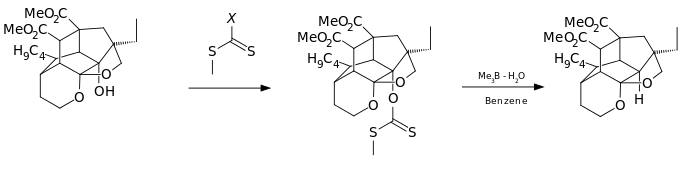
Una variación de esta reacción se ha utilizado en uno de los pasos de la síntesis total de la azadiractina:[6]
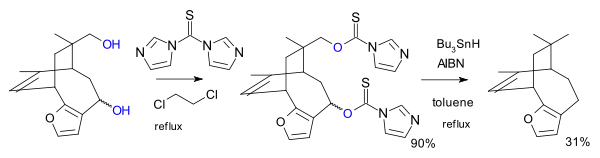
En otra variación, el reactivo empleado en lugar del cloruro de ácido tiocarboxílico es el imidazol 1,1'-tiocarbonildiimidazol (TCDi), por ejemplo, en la síntesis total de palescensina B.[7] El TCDi es especialmente adecuado si el sustrato es un alcohol primario porque no hay una estabilización por resonancia del xantato ya que el par electrónico del nitrógeno imidazolico está involucrado en el sexteto aromático.
La reacción también se aplica a S-alquilxantatos. Con trietilborano como un reactivo novedoso libre de metales, los átomos de hidrógeno requeridos se abstraen de disolventes próticos, la pared del reactor e incluso (en condiciones estrictamente anhidras) el mismo borano.
Referencias
- Barton, D. H. R.; McCombie, S. W. (1975). «A new method for the deoxygenation of secondary alcohols». J. Chem. Soc., Perkin Trans. 1 16: 1574-1585. doi:10.1039/P19750001574.
- Crich, D.; Quintero, L. (1989). «Radical chemistry associated with the thiocarbonyl group». Chem. Rev. 89: 1413-1432. doi:10.1021/cr00097a001.
- Forbes, J. E.; Zard, S. Z. Tetrahedron Lett. 1989, 30, 4367.
- α-D-Ribo-hexofuranose, 3-deoxy-1,2:5,6-bis-O-(1-methylethylidene). Tormo, J.; Fu, G. C. Org. Syn., Coll. Vol. 10, p.240 (2004); Vol. 78, p.239 (2002). (Article Archivado el 14 de mayo de 2011 en Wayback Machine.)
- Deoxygenation of Alcohols Employing Water as the Hydrogen Atom Source David A. Spiegel, Kenneth B. Wiberg, Laura N. Schacherer, Matthew R. Medeiros, and John L. Wood J. Am. Chem. Soc. 2005, 127, 12513-12515. (doi 10.1021/ja052185l)
- Synthesis of Azadirachtin: A Long but Successful Journey Gemma E. Veitch, Edith Beckmann, Brenda J. Burke, Alistair Boyer, Sarah L. Maslen, and Steven V. Ley Angew. Chem. Int. Ed. 2007, doi 10.1002/anie.200703027 DOI: 10.1002/anie.200703027
- Chem. Commun., 1999, 117–118 117 Article