Región determinante de la complementariedad
La región determinante de la complementariedad (en inglés complementarity determining region o CDR) es una secuencia corta de aminoácidos que se encuentra en los dominios variables de proteínas con función de receptor de antígenos (inmunoglobulinas y receptores de linfocitos T) que complementa al antígeno y por tanto le da a este receptor su especificidad para el antígeno en particular.
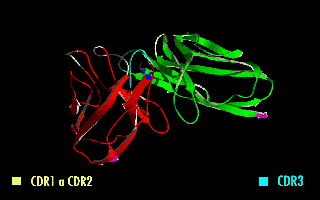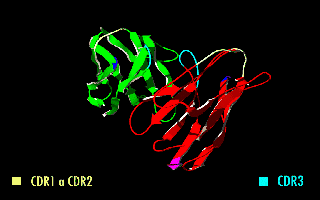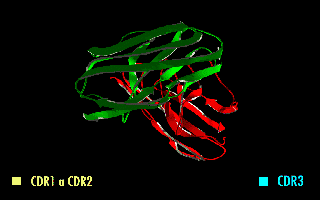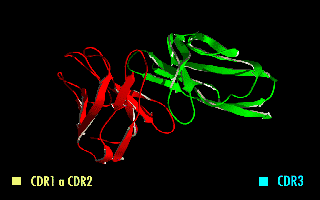
Cada cadena de polipéptido de un receptor de antígenos contiene tres CDRs (CDR1, CDR2 y CDR3). Ya que los receptores de antígeno están típicamente compuestas de dos cadenas polipeptídicas hay seis CDRs por cada receptor de antígeno que pueden ponerse en contacto con el antígeno (tres CDRs en la cadena pesada, y tres en la ligera), y doce CDRs en cada molécula de anticuerpo habiendo, entonces, sesenta CDRs en una molécula pentamérica de IgM.
Puesto que la mayor parte de la variación de secuencias que se asocia con las inmunoglobulinas y receptores del linfocito T se encuentra en las CDRs, a estas regiones se las suele denominar "dominios hipervariables".[1] Entre estos, el CDR3 muestra la mayor variabilidad y está codificado por una combinación entre los segmentos de las regiones VJ (VDJ en el caso de las cadenas pesadas).
Referencias
- Abbas AK and Lichtman AH (2003). Cellular and Molecular Immunology (5th ed. edición). Saunders, Philadelphia. ISBN 0-7216-0008-6.
Enlaces externos
- MeshName: Complementarity+determining+regions (enlace roto disponible en Internet Archive; véase el historial, la primera versión y la última). (inglés)