Síndrome de Asherman
El síndrome de Asherman (SA), también conocido como “synechiae uterino”, sinequia intrauterina o adherencias intrauterinas (AIU), es llamado así por el médico ginecólogo israelí Josef Asherman que lo definió.[1] Muestra una condición caracterizada por la presencia de adherencias y/o fibrosis dentro de la cavidad uterina debido a cicatrices. Innumerables términos se han utilizado para describir la condición o condiciones afines incluyen: adherencias intrauterinas traumáticas, atresia cérvico-uterino, atrofia uterina traumática, endometría esclerótica, esclerosis endometrial. En este artículo SA y AIU son términos intercambiables.
| Síndrome de Asherman | ||
|---|---|---|
| Especialidad | ginecología | |
| Sinónimos | ||
|
Adherencias intrauterinas Sinequia intrauterina | ||
Causas y características
La cavidad uterina está revestida por el endometrio. Esta cubierta por dos capas, la capa funcional la cual se deshace durante la menstruación y una capa elemental subyacente la cual es necesaria para la regeneración de la capa funcional. La capa elemental sufre trauma típicamente después de una dilatación y curetaje (D&C) realizado después de un aborto, o un nacimiento o por un aborto optativo que puede llevar a la aparición de cicatrices intrauterinas resultando en adherencias que pueden borrar la cavidad a distintos grados. En un caso extremo, la cavidad entera ha sido marcada y obstruida. Incluso con muy pocas cicatrices, el endometrio puede no responder a los estrógenos y reposar. Frecuentemente, las pacientes experimentan irregularidades menstruales secundarias caracterizadas por cambios en el flujo y duración del sangrado (amenorrea, hipomenorrea o oligomenorrea)[2] y convertirse en estéril. Anomalías menstruales son frecuentes pero no siempre correlacionadas con severidad: adherencias restringidas solo a cuello del útero o la parte baja del útero podría bloquear la menstruación. Dolor durante la menstruación y la ovulación son también experimentados en ocasiones y pueden ser atribuidos a obstrucciones.
El síndrome de Asherman (SA), ocurre más frecuentemente después de un procedimiento de D&C en un útero recientemente embarazado, seguido de un aborto espontáneo incompleto o fallido, nacimiento, o una terminación optativa (aborto) para remover tejidos de concepción retenidos. Como el mismo procedimiento es utilizado en las tres situaciones, SA puede provocar todas las circunstancias que se señalan anteriormente. Afecta a mujeres de todas las razas y edades por lo que no existe una predisposición adyacente o bases genéticas para su desarrollo. Según un estudio realizado a 1900 pacientes con SA, más del 90% de los casos se registraban después de un curetaje debido a un embarazo.[3] Dependiendo del grado de severidad, SA puede provocar infertilidad, abortos repetitivos, dolores por la sangre retenida, y futuras complicaciones obstétricas[4] (ver Prognosis abajo). Existe evidencia que el dejar sin tratamientos, la obstrucción del flujo menstrual como resultado de adherencias, puede provocar endometriosis.[5] SA puede también ser el resultado de otras cirugías pélvicas, incluyendo cesáreas,[3][6] extracción de tumores de fibrosis (myomectomía) y de otras causas como IUDs, irradiación pélvica, esquistosomiasis[7] y tuberculosis genital.[8] La endometritis crónica de una tuberculosis genital es una causa significativa de una severa AIU en el mundo desarrollado, con frecuencia da como resultado una total obstrucción de la cavidad uterina lo cual es difícil de tratar.[9]
Un estudio encontró una correlación significativa entre anomalías Müllerianas y adherencias intrauterinas.[10] Esta correlación aparente es porque las mujeres con anomalías uterinas congénitas están predispuestas a abortos,[11][12] y por ende podrían tener también más altos índices de D&C ejecutados que la población en general, lo que podría aumentar más el índice de AIU observados.[13] Es también posible que mujeres con septate uteri y otras afecciones Müllerianas tengan un alto riesgo de daño endometrial continuo después de efectuar un D&C debido a su anatomía atípica, particularmente si el doctor realiza una cirugía sin conocimiento del mismo.
Una forma de SA artificial puede ser inducida quirúrgicamente por ablación endometrial en mujeres con sangrado uterino excesivo, en vez de efectuar una histerectomía.
Incidencia
El Síndrome de Asherman ha sido reportado como consecuencia de 25% de D&C realizados entre 1 y 4 semanas después del parto,,[14][15][6] hasta 30,9% de D&C realizados en casos de pérdida del feto por aborto involuntario y 6,4% de dilataciones y legrados realizados en caso de abortos incompletos.[16] En otro estudio, el 40% de los pacientes que sufrieron repetidas D&C por causa de retención de tejidos conservados en el úteroutero después de un aborto involuntario o placenta retenida manifestaron el Síndrome de Asherman.[17] En el caso de pérdida por abortos involuntarios, el tiempo que transcurre entre la pérdida del feto y el curetaje pueden aumentar la probabilidad de la formación de adherencias debido a la actividad fibroblástica del tejido remanente.[3][18] El riesgo del SA también aumenta con la cantidad de procedimientos: un estudio estimó que el riesgo podría ser del 16% después de una D&C y el 32% después de 3 o más D&C,[19] sin embargo un solo curetaje es a menudo causante del síndrome.
Predominio en la Población General
El predominio verdadero del SA está confuso así como muchos doctores desconocen los síntomas o el diagnóstico. Se estima que hasta el 5% de las D&C causan el SA [cita requerida]. Estimaciones más conservadoras pusieron este índice en el 1% [cita requerida], sin embargo, esto parece ser desestimado dado la incidencia de las adherencias intrauterinas siguiendo el curetaje reportado en estudios prospectivos y la cantidad de dilataciones y curetajes realizados anualmente. El aumento de la concienciacion de la condición y su diagnóstico también esperó revelar una frecuencia más alta que la divulgada previamente. La condición fue encontrada en 1,5% de las mujeres que demostraron HSG, 18 y entre 5 y el 39% de mujeres con abortos involuntarios repetitivos. 19 20 21.
Diagnóstico
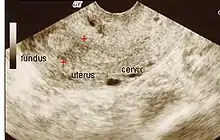
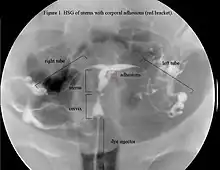
La historia del acontecimiento del embarazo seguido por la dilatación y el legrado liderizado por la amenorrea secundaria o a la hipomenorrea es común. La histeroscopia es el estándar de oro para el diagnóstico. 3 La proyección de sonohisterografía o histerosalpingografía podría revelar el grado de la formación de la cicatriz. El ultrasonido no es un método confiable de diagnosticar el Síndrome de Asherman. Los estudios de la hormona muestran los niveles normales constantes con la función reproductiva.
Prevención
El útero recientemente embarazado es particularmente suave bajo la influencia de hormonas y por lo tanto, susceptible de ser afectado fácilmente. D&C (incluyendo dilatación y curetaje, dilatación y curetaje de evacuación/succión y aspiración manual) es un procedimiento invasor, haciendo difícil de evitar trauma endometrial. Las alternativas médicas de dilatación y curetaje para la evacuación de la placenta/los productos de la concepción existen incluyendo misoprostol y mifepristona o RU486. Los estudios muestran este método menos invasor y más barato para ser eficaces, seguro y una alternativa aceptable al tratamiento quirúrgico para la mayoría de las mujeres. 29 30 Fue sugerido desde 1993 17 ya que la incidencia de IUA (siglas en inglés de adherencias intrauterinas) pudo ser una evacuación médica más baja (eg. Misoprostol) del útero, así evitando cualquier instrumentación intrauterina. Hasta ahora, un estudio apoya esta propuesta, demostrando que las mujeres que fueron tratadas por aborto involuntario con misoprostol no desarrollaron adherencias intrauterinas, mientras que el 7.7% de las que fueron sometidas a un D&C sí. 31 La ventaja del misoprostol es que se puede usar para la evacuación no sólo después de un parto, sino también después de la retención de placenta o hemorragia después de un parto. Por otra parte, el D&C puede realizarse con el apoyo de una ecografía, mejor que a ciegas. Esto permitiría al cirujano poner fin al raspado de la línea del endometrio cuando todas las fibras retenidas han sido sacadas, evitando un daño. La monitorización temprana durante el embarazo para identificar el aborto puede prevenir el desarrollo de, o según sea el caso, la reaparición de AS (siglas en inglés de Asherman) debido a que cuando más tiempo transcurre entre la muerte fetal y el curetaje, más propensas son las adherencias a producirse. Por lo tanto, la evacuación inmediata tras la muerte fetal y el curetaje puede prevenir las adherencias intrauterinas. El uso de la cirugía histeroscópica en vez de D&C para remover los productos de la concepción o de la placenta es otra alternativa, aunque podría ser menos eficaz si el tejido es abundante. También la histeroscopia no es una técnica usada extensamente o rutinariamente. No hay evidencias que sugieran que el curetaje por succión sea menos propenso a producir adherencias intrauterinas. Un reciente artículo describe tres casos de mujeres quienes desarrollaron adherencias intrauterinas siguiendo la aspiración manual. Historia El síndrome de Asherman fue definido en 1894 por Henry Fritch (Fritch, 1984) y ampliamente estudiado por el ginecólogo Joseph Asherman en 1948. Es también conocido como el síndrome de Fritsch o el síndrome Fritsch-Asherman.
Clasificación
Los diversos sistemas de clasificación fueron desarrollados para describir el síndrome de Asherman (citaciones por añadir), algunas teniendo en cuenta el funcionamiento de la cantidad de endometrio residual, el ciclo menstrual, la historia obstétrica y otros factores piensan juegan un papel en la determinación de los pronósticos. Con el advenimiento de las técnicas que permiten la visualización del útero, los sistemas de clasificación fueron desarrollados para tener en cuenta la ubicación y la severidad de adherencias dentro del útero. Esto es útil como las casos de adherencias restringidas leves a la cerviz pueden presentar con amenorrea e infertilidad, mostrando que los síntomas solamente no reflejan necesariamente severidad. Otros pacientes no pueden tener ninguna adherencia sino la amenorrea e infertilidad debido a un endometrio atrófico esclerótico. La última forma tiene el peor pronóstico.
Tratamiento
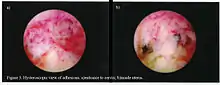
La fertilidad se puede restaurar con el retiro de adherencias, dependiendo de la severidad del trauma inicial y de otros factores según el paciente. Histeroscopia operativa se utiliza para la inspección visual de la cavidad uterina durante la disección de la adherencia (adhesiólisis). Sin embargo, histeroscopia puede convertirse todavía en un procedimiento ginecológico rutinario y el solamente 15% de ginecólogos de los EE. UU. realiza en sus clínicas la histeroscopia {Isaacson, 2002}. La disección de la adherencia puede ser técnicamente difícil y se debe realizar con cuidado para no crear nuevas cicatrices y no exacerbar más la condición. En casos más severos, las medidas adjuntivas tales como laparoscopia se utilizan en el conjunción con histeroscopia como medida protectora contra la perforación uterina. Las microtijeras se utilizan generalmente para cortar adherencias. La electrocauterización no se recomienda.[20]
Mientras que IUA vuelven a formarse con frecuencia después de cirugía, las técnicas se han mejorado para prevenir la repetición de adherencias. Los métodos para prevenir la formación de adherencias incluyen en el uso de las barreras mecánicas (catéter de Foley, tubo (stent) especial Globo Médico Salino relleno de solución salina de Cook, DIUC –Dispositivo IntraUterino Contraceptivo) y barreras de gel (Seprafilm, Spraygel, gel autocrosslinked del ácido hialurónico) para mantener las paredes de oposición separadas durante la cura {Tsapanos, 2002}; {Guida, 2004}; {Abbott, 2004}, de tal modo previniendo la reforma de adherencias. La profilaxis de antibióticos es necesaria en presencia de barreras mecánicas para reducir el riesgo de posibles infecciones. Un método farmacológico común para prevenir la formación de adherencias es la terapia hormonal secuencial con el estrógeno seguido por una progestina para estimular crecimiento endometrial y para evitar la oposición de las paredes de la fusión junto {Roge, 1996}. Aunque no ha habido PCA’s comparando la reformación adherente post-quirúrgicas con y sin tratamiento hormonal, y el régimen de dosis ideal o larga duración de terapia de estrógeno aún es desconocido. La ausencia de prospective de pruebas de control aleatorias (PCA’s) para comparar métodos de tratamientos hace difícil el recomendar protocolos de tratamiento óptimos. Además, la severidad y los resultados de diagnóstico se evalúan según diversos criterios (eg. modelo, tarifa de la reforma de la adherencia, tarifa del concepto, tarifa menstruales del nacimiento). Claramente, se necesitan estudios más comparables en los cuales el resultado reproductivo se puede analizar sistemáticamente. Las pruebas de la continuación (HSG, histeroscopia o SHG) son necesarias para asegurar que las adherencias no han reformado. La cirugía adicional puede ser necesaria para restaurar una cavidad uterina normal. Según un estudio reciente entre 61 pacientes, el índice total de repetición de la adherencia era 27,9% y en casos severos era de un 41,9%.[21] Otro estudio encontró que la adhesión post-operatoria reocurre casi un 50% de SA (Síndrome de Asherman) y en un 21.6% de casos moderados. IA (Adherencias Intrauterinas) Leve, a diferencia de adhesión severa, aparentemente no se vuelven a formar.
Prognosis
La extensión de la formación de la adherencia es crítica. Las adherencias leves o moderadas pueden ser tratadas con éxito. Una extirpación extensa de la cavidad uterina o trompas de Falopio (ostium) al igual que los traumatismos del endometrio o miometrio puede necesitar varias cirugías y/o terapias hormonales y hasta pueden no tener solución. Si la cavidad endometrial no tiene ninguna adherencia pero el ostium permanece obliterado, la fecundación in vitro (FIV) sigue siendo una opción. Si el útero ha sido dañado de forma irreparable, un vientre de alquiler o la adopción pueden ser las únicas opciones. Las pacientes que han gestado un embarazo incluso después del tratamiento para adherencias intrauterinas pueden presentar alto riesgo de tener una placentación anormal incluyendo placenta acreta en donde la placenta invade el útero de forma más profunda conllevando a complicaciones de separación placentaria después del parto.[22] Otras complicaciones conocidas son parto prematuro, aborto en el segundo trimestre y desgarre del útero.[23] También pueden desarrollar un cuello uterino deficiente, donde el cérvix ya no puede sostener el peso creciente del feto, la presión causa que la placenta se desgarre y la madre sufre un parto prematuro. Cerclaje es una sutura quirúrgica que ayuda a sostener el cuello uterino de ser necesario. Se ha dado a conocer que las tasas de embarazo y natalidad se relacionan con la gravedad inicial de las adherencias con un 93, 78 y 57% de embarazos exitosos luego del tratamiento de adherencias leves, moderadas y graves, respectivamente y con un resultado de 81, 66 y 32% de tasa de natalidad respectivamente. La tasa de embarazo general luego de la adhesiólisis fue de un 60% y la tasa de natalidad de un 38% de acuerdo a un estudio.[24] La edad es otro factor que contribuye a los resultados de la fertilidad después del tratamiento de del Síndrome de Asherman. Para mujeres menores de 35 años tratadas por adherencias severas las tasas de embarazo fueron de un 66.6% comparado con un 23.5% en mujeres mayores de 35.
Referencias
- Smikle, Collin; Yarrarapu, Siva Naga S.; Khetarpal, Shailesh (2021). Asherman Syndrome. StatPearls Publishing. Consultado el 11 de noviembre de 2021.
- Klein SM, Garcia C-R (1973). «Asherman's syndrome: a critique and current review». Fertility and Sterility 24 (9): 722-735. PMID 4725610.
- Schenker JG, Margalioth EJ. (1982). «Intra-uterine adhesions: an updated appraisal». Fertility and Sterility 37 (5): 593-610. PMID 6281085.
- Valle RF, and Sciarra JJ (1988). «Intrauterine adhesions: Hystreoscopic diagnosis, classification, treatment and reproductive outcome». . Am J Obstet 158 (6Pt1): 1459-1470. PMID 3381869.
- Palter S (2005). «High Rates of Endometriosis in Patients With Intrauterine Synechiae (Asherman’s Syndrome)». Fertility and Sterility 86 (null): S471-S471.
- Rochet Y, Dargent D, Bremond A, Priou G, Rudigoz RC (1979). «The obstetrical outcome of women with surgically treated uterine synechiae (in French)». J Gynecol Obstet Biol Reprod 8 (8): 723-726. PMID 553931.
- Krolikowski A, Janowski K, Larsen JV. (1995). «Asherman syndrome caused by schistosomiasis». Obstet Gynecol. 85 (5Pt2): 898-9. PMID 7724154. doi:10.1016/0029-7844(94)00371-J.
- Netter AP, Musset R, Lambert A Salomon Y (1956). «Traumatic uterine synechiae: a common cause of menstrual insufficiency, sterility, and abortion». Am J Obstet Gynecol. 71 (2): 368-75. PMID 13283012.
- Bukulmez O, Yarali H, Gurgan T. (1999). «Total corporal synechiae due to tuberculosis carry a very poor prognosis following hysteroscopic synechialysis». Hum Reprod 14 (8): 1960-1961. PMID 10438408. doi:10.1093/humrep/14.8.1960.
- Stillman RJ, Asarkof, N (1985). «Association between mullerian duct malformations and Asherman syndrome in infertile women». Obstet Gynecol 65 (5): 673-7. PMID 3982744.
- Worthen NJ, Gonzalez F. (1984). «Septate uterus: sonographic diagnosis and obstetric complications». Obstet Gynecol 64 (3 Suppl): 34S-38S. PMID 6472746.
- Buttram VC, Turati, G (1977). «Uterine synechiae: variations in severity and some conditions which may be conducive to severe adhesions». Int J Fertil 22 (2): 98-103. PMID 20418.
- March CM. (1995). «Intrauterine adhesions». Obstet Gynecol Clin N Am 22: 98-103.
- Parent B, Barbot J, Dubuisson JB. Uterine synechiae (in French). Encyl Med Chir Gynecol 1988; 140A (Suppl): 10-12.
- Buttram UC, Turati G. (1977). «Uterine synechiae: variation in severity and some conditions which may be conductive to severe adhesions». Int J Fertil 22 (2): 98-103. PMID 20418.
- Adoni A, Palti Z, Milwidsky A, Dolberg M. (1982). «The incidence of intrauterine adhesions following spontaneous abortion». Int J Fertil. 27 (2): 117-118. PMID 6126446.
- Westendorp ICD, Ankum WM, Mol BWJ, Vonk J. (1998). «Prevalence of Asherman's syndrome after secondary removal of placental remnants or a repeat curettage for incomplete abortion». Hum Reprod 13 (12): 3347-3350. PMID 9886512. doi:10.1093/humrep/13.12.3347.
- Fedele L, Bianchi S, Frontino G. Septums and synechiae: approaches to surgical correction. Clin Obstet Gynecol 2006; 49:767-788.
- Friedler S, Margalioth EJ, Kafka I, Yaffe H. (1993). «Incidence of postabortion intra-uterine adhesions evaluated by hysteroscopy: a prospective study». Hum Reprod 8 (3): 442-444. PMID 8473464.
- Kodaman PH, Arici AA. (2007). «Intra-uterine adhesions and fertility outcome: how to optimize success?». Curr Opin Obstet Gynecol 19 (3): 207-214. PMID 17495635.
- Yu D, Li T, Xia E, Huang X, Peng X. (2008). «Factors affecting reproductive outcome of hysteroscopic adhesiolysis for Asherman's syndrome». Fertility and Sterility 89 (3): 715-722. PMID 17681324. doi:10.1016/j.fertnstert.2007.03.070.
- Fernandez H, Al Najjar F, Chauvenaud-Lambling et al. (2006). «Fertility after treatment of Asherman's syndrome stage 3 and 4». J Minim Invasive Gynecol 13 (5): 398-402. PMID 16962521. doi:10.1016/j.jmig.2006.04.013.
- Roge, P (1996). «Hysteroscopic management of uterine synechiae: a series of 102 observations». Eur J Obstet Gynecol Reprod Biol 65 (2): 189-193. PMID 8730623. doi:10.1016/0301-2115(95)02342-9.
- Capella-Allouc S, Morsad F, Rongieres-Bertrand C, et al. Hysteroscopic treatment of severe Asherman's syndrome and subsequent fertility. Hum Reprod; 14:1230-1233.
Enlaces externos
- Síndrome de Asherman, Histeroscopia.es
- Asherman's Youtube channel
- Ashermans.org Patient support group run by patients.
- Overview at iVillage
- The Hidden Threat to Fertility by Catherine Bruton, Times UK Online
- Ashermans.org Youtube channel
- Blog: Asherman's Syndrome Watch (awareness, prevention and activism)