Sal ácida
Las sales ácidas son una clase de sales que producen una solución ácida después de ser disueltas en un disolvente. Su formación como sustancia tiene una mayor conductividad eléctrica que la del disolvente puro.[1]
En la molécula de las sales ácidas se presenta la unión de un metal a un radical negativo y un no metal positivo, pero entre ellos se encuentra el hidrógeno. Para nombrarlas se utiliza el nombre del radical para las sales con el prefijo bi y después se anota el nombre del metal.
Normalmente cuando reacciona una base con un ácido, ésta pierde todos los grupos (OH) y el ácido pierde todos los hidrógenos (H) formándose una sal neutra, pero cuando el ácido conserva por lo menos 1 de los hidrógenos se obtiene una sal ácida.
Ejemplos:
- LiOH + H2CO3 → LiHCO3 + H2O bicarbonato de litio
- Fe(OH)2 + 2H2CO3 → Fe(HCO3)2 + 2H2O bicarbonato ferroso
Hay dos tipos de sales:
- Sales ácidas, como: NaOH + H2CO3 → NaHCO3 + H2O
- Sales básicas, como: Mg(OH)2 + HCl → Mg(OH)Cl + H2O
Cálculo de pH en una solución de sal ácida
Para obtener el pH de una solución de sal ácida se debe aplicar la siguiente ecuación:
- pH = 1/2(Pka1 + Pka2)
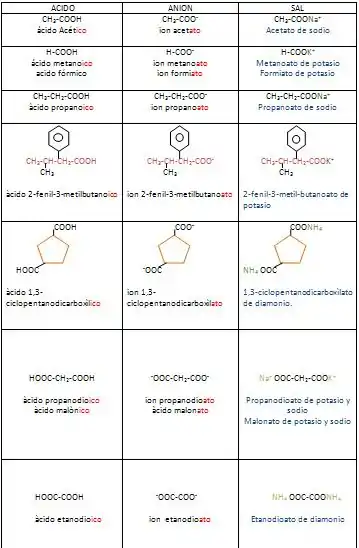
Nomenclatura para química orgánica
Los aniones de los ácidos carboxílicos se nombran reemplazando la terminación ico del ácido por la terminación ato (tal como se lleva a cabo en química inorgánica).
- Ejemplos:
Referencias
- Cady, H. P.; Elsey, H. M. (1928). «A general definition of acids, bases, and salts». Journal of Chemical Education 5 (11): 1425. Bibcode:1928JChEd...5.1425C. doi:10.1021/ed005p1425.