Saponificación
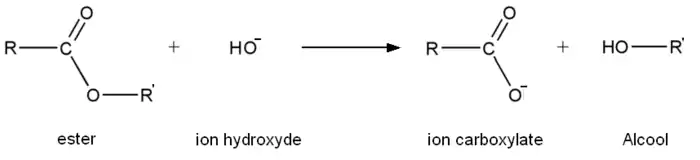
Saponificación es el nombre con el que se conoce el proceso químico de la hidrólisis de un éster en un medio básico, por el cual un cuerpo graso, unido a una base y agua, da como resultado jabón y glicerina. Se llaman jabones a las sales sódicas y potásicas derivadas de los ácidos grasos. Son susceptibles de saponificación todas aquellas sustancias que en su estructura molecular contienen restos de ácidos grasos, y son sustancias naturales a las que llamamos lípidos saponificables. Los lípidos saponificables más abundantes en la naturaleza son las grasas neutras o glicéridos. La saponificación de un diglicérido se resume así:
- grasa + sosa cáustica → jabón + glicerina
Este proceso químico es utilizado como un parámetro de medición de la composición y calidad de los ácidos grasos presentes en los aceites y grasas de origen animal o vegetal, denominándose este análisis como Índice de saponificación; el cual es un método de medida para calcular el peso molecular promedio de todos los ácidos grasos presentes. Igualmente este parámetro es utilizado para determinar el porcentaje en los cuerpos grasos de materias insaponificables, es decir, sustancias que no contienen ácidos grasos.
Un método de saponificación común en el aspecto industrial consiste en hervir la grasa en grandes calderas, añadir lentamente hidróxido de sodio (NaOH) y agitarlo continuamente hasta que la mezcla comienza a ponerse pastosa.
Historia
Inicialmente, esta reacción era conocida por transformar la mezcla de un éster de glicerol y de una base fuerte en una mezcla de jabones (o sales de ácidos grasos) y glicerol, de ahí su nombre. Fue identificada en 1823 por el químico francés Michel-Eugène Chevreul (1786-1889), que en Recherches chimiques sur les corps gras d'origine animale explicó la reacción química de la saponificación y la composición de la estearina. Demostró que los triglicéridos pueden considerarse combinaciones químicas entre el glicerol y los ácidos grasos (en otras palabras, un triglicérido es un compuesto cuya molécula contiene un residuo de glicerol y tres residuos de ácidos grasos).
Mecanismo
El mecanismo de la reacción se descompone en tres etapas (más una acidificación del medio si se desea volver a obtener un ácido carboxílico y ya no un ion carboxilato).
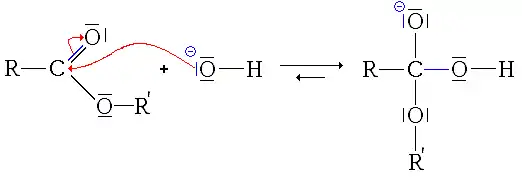
- Primer paso: adición nucleófila del ion HO−al éster.
- Segundo paso: eliminación del grupo alcoholato.
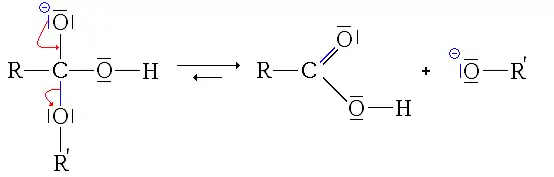
- En este paso, la reacción podría completarse y tener una utilidad (para hidrolizar un éster, sería suficiente agregar soda o potasa). Este paso forma un ácido carboxílico, ácido débil (pKa generalmente entre 3 y 4, pero relativamente más fuerte en el medio, siendo el otro el agua) y una base muy fuerte, el ion alcoholato (pKa entre 18 y 20). Por lo tanto, hay una reacción ácido-base entre el ácido más fuerte y la base más fuerte, por lo tanto, la conversión del ácido carboxílico en ion carboxilato.
- Tercer paso: reacción ácido-base entre el ácido carboxílico y el ion alcoholato.
Como puede verse, esta reacción es el único mecanismo irreversible y (casi) total (1014 < K < 1017). Por lo tanto, desplaza los equilibrios de las reacciones anteriores (al consumir sus productos por completo), haciéndolos también totales (o casi).
En el contexto de la síntesis de un jabón, se puede parar en esta última etapa. Por otro lado, si se quiere obtener un ácido carboxílico, hay que volver a acidificar el medio:
Tipos de lípidos por sus características de saponificación
Lípidos saponificables
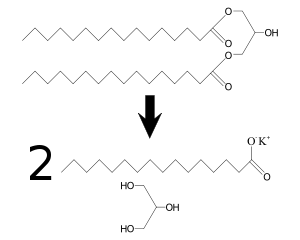
Un lípido saponificable sería todo aquel que esté compuesto por un alcohol unido a uno o varios ácidos grasos (iguales o distintos). Esta unión se realiza mediante un enlace éster, muy difícil de hidrolizar. Pero puede romperse fácilmente si el lípido se encuentra en un medio básico. En este caso se produce la saponificación alcalina. En los casos en los que para la obtención del jabón se utiliza un glicérido o grasa neutra, se obtiene como subproducto el alcohol llamado glicerina, que puede dar mayor beneficio económico que el producto principal.
En el ejemplo de arriba una molécula de un lípido es tratada con dos de hidróxido de potasio; se obtienen dos moléculas de palmitato de potasio (un jabón) y una de glicerina.
La acción limpiadora del jabón se debe a su poder emulsionante, esto es, su habilidad para suspender en agua sustancias que normalmente no se disuelven en agua pura. La cadena hidrocarbonada (parte hidrofóbica) de la sal (el jabón), tiene afinidad por sustancias no polares, tales como las grasas de los alimentos. El grupo carboxilato (parte hidrofílica) de la molécula tiene afinidad por el agua.
En la solución de jabón, los iones carboxilato rodean a las gotas de grasa: sus partes no polares se ubican (disuelven) hacia adentro, mientras que los grupos carboxilato se ordenan sobre la superficie externa. Así, reducidas a volúmenes muy pequeños, las gotas pueden asociarse con las moléculas de agua y se facilita la dispersión de la grasa. Estas pequeñas gotas que contienen las partículas no polares rodeadas de aniones carboxilato se denominan micelas. Es la presencia de estos aniones carboxilato la que hace que las superficies de las micelas estén cargadas negativamente y se repelan entre sí, impidiendo la coalescencia y manteniendo la emulsión, es decir la dispersión en gotas muy finas.
Transparencia del jabón
La transparencia del jabón depende del contenido de ácidos grasos.[1] Un exceso de este hace que sea opaco y de consistencia lechosa.
Cuando se hace un jabón mediante un procedimiento en frío, el jabón saldrá opaco, aun así las medidas de álcalis y aceites hayan sido muy precisas, ya que este proceso rara vez produce el calor suficiente para neutralizar por completo los ácidos grasos.
El proceso en caliente incorpora el calor de la cocina al calor químico producido por la saponificación. Este calor añadido une todos los ácidos grasos con el álcali y como resultado se obtiene un jabón transparente y neutro.
La saponificación es una reacción química que produce calor, y cuanto más calor produzca más completa será la saponificación.