Teoría de Marcus
La teoría de Marcus (denominada en algunas de sus formulaciones teoría de Marcus-Hush-Jortner),[1] es una teoría desarrollada originalmente en 1956 por el químico canadiense, nacionalizado estadounidense, Rudolph A. Marcus, para explicar las tasa de transferencia electrónica en las reacciones químicas– la tasa a la que los electrones pueden moverse o saltar de una especie química (llamada donante) a otra (llamada aceptora). Originalmente fue formulada para tratar las reacciones de transferencia electrónica de esfera externa, en la que dos especies químicas no están enlazadas directamente la una a la otra, pero después fue ampliada a las reacciones de transferencia electrónica de esfera interna, en la que dos especies químicas están unidas por un puente químico, por Noel S. Hush (la formulación de Hush se conoce como la teoría de Marcus-Hush). Marcus recibió el Premio Nobel de Química en 1992 por su teoría. La teoría de Marcus se usa para describir varios procesos importantes en química y biología, incluyendo la fotosíntesis, la corrosión, ciertos tipos de quimioluminiscencia, separación de cargas en algunos tipos de paneles solares, etc. Además de las aplicaciones de esfera interna y externa, la teoría de Marcus se ha ampliado para cubrir la transferencia electrónica heterogénea. La teoría de Marcus se basa en la tradicional ecuación de Arrhenius para las tasas a las que se dan las ecuaciones químicas de dos modos:
- Proporciona la fórmula para el factor preexponencial en la ecuación de Arrhenius basada en el acoplamiento electrónico entre el estado inicial y final de la reacción de transferencia de electrones (es decir, el solapamiento de la función de ondas de ambos estados).
- Proporciona la fórmula de la energía de activación, basándose en un parámetro llamado energía de reorganización, así como la energía libre de Gibbs. La energía de reorganización se define como la energía que se requiere para "reorganizar" la estructura del sistema desde las coordenadas iniciales a las finales, sin cambiar el estado electrónico.
La teoría de Marcus es actualmente la teoría dominante sobre la transferencia electrónica en química. Tiene tan amplia aceptación porque realiza sorprendentes predicciones sobre las tasas de transferencia electrónica que no obstante han sido apoyadas por la evidencia experimental a lo largo de las últimas décadas. La predicción más significativa es que la tasa de transferencia electrónica se incrementa a medida que la reacción se hace más exergónica – pero solo hasta un punto. Pasado ese punto, la tasa de transferencia electrónica realmente disminuirá a medida que se hace más exergónica en la llamada "región invertida de Marcus". Este aspecto de la teoría de Marcus era controvertido en el momento en que la teoría fue propuesta en 1956 hasta que el grupo de John Milleren el laboratorio Nacional Argonne National encontraron evidencia empírica para ello en 1986.[2]
La ecuación básica de la teoría de Marcus es:
Donde es la tasa de transferencia electrónica, es el acoplamiento electrónico entre los estados inicial y final, es la energía de reorganización (tanto en la esfera interna como en la externa), y es el cambio total de la energía libre de Gibbs total para la reacción de transferencia electrónica( es la constante de Boltzmann). A continuación se presenta un diagrama de los parámetros clave:
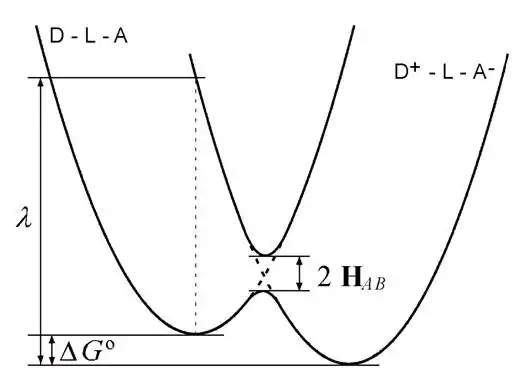
En este diagrama, el eje vertical representa la energía libre, y el horizontal la "coordenada de reacción" – un eje simplificado que representa el movimiento de todos los núcleos atómicos. La parábola de la izquierda representa la superficie de energía potencial para el movimiento nuclear de los reactivos en su estado inicial (donde el electrón aún es el grupo de la molécula donante) y la de la derecha representa la superficie de energía potencial para el movimiento nuclear de los productos en el estado final (después de que el electrón se haya transferido desde el donante al aceptor). La inusual dependencia de la tasa de transferencia electrónica de los cambios de energía libre (es decir, el término en la ecuación), que conduce a la región invertida de Marcus, se deduce simplemente de asumir que la energía potencial de los estados inicial y final varía cuadráticamente con alguna reacción de coordenada (es decir, que ambas superficies de energía potencial son parábolas), resolviéndose para la energía de activación en términos de y , e incorporando el resultado a la ecuación de Arrhenius.
Publicaciones clave de Marcus
- Marcus, R.A (1956). «On the Theory of Oxidation-Reduction Reactions Involving Electron Transfer. I». J. Chem. Phys. 24: 966. doi:10.1063/1.1742723.
- Marcus, R.A (1956). «Electrostatic Free Energy and Other Properties of States Having Nonequilibrium Polarization. I». J. Chem. Phys. 24: 979. doi:10.1063/1.1742724.
- Marcus, R.A (1957). «On the Theory of Oxidation-Reduction Reactions Involving Electron Transfer. II. Applications to Data on the Rates of Isotopic Exchange Reactions». J. Chem. Phys. 26: 867. doi:10.1063/1.1743423.
- Marcus, R.A (1957). «On the Theory of Oxidation-Reduction Reactions Involving Electron Transfer. III. Applications to Data on the Rates of Organic Redox Reactions». J. Chem. Phys. 26: 872. doi:10.1063/1.1743424.
- Marcus, R.A (1960). «Exchange reactions and electron transfer reactions including isotopic exchange. Theory of oxidation-reduction reactions involving electron transfer. Part 4.—A statistical-mechanical basis for treating contributions from solvent, ligands, and inert salt». Disc. Faraday Soc. 29: 21. doi:10.1039/df9602900021.
- Marcus, R.A (1963). «On The Theory Of Oxidation--Reduction Reactions Involving Electron Transfer. V. Comparison And Properties Of Electrochemical And Chemical Rate Constants». J. Phys. Chem. 67: 853. doi:10.1021/j100798a033.
- Marcus, R.A (1964). «Chemical and Electrochemical Electron-Transfer Theory». Annu. Rev. Phys. Chem. 15: 155. doi:10.1146/annurev.pc.15.100164.001103.
- Marcus, R.A (1965). «On the Theory of Electron-Transfer Reactions. VI. Unified Treatment for Homogeneous and Electrode Reactions». J. Chem. Phys. 43: 679. doi:10.1063/1.1696792.
- Marcus, R.A.; Sutin N (1985). «Electron transfers in chemistry and biology». Biochim. Biophys. Acta. 811: 265. doi:10.1016/0304-4173(85)90014-X.
Referencias
- NanoBioTechnology: bioinspired devices and materials of the future. Humana Press. 2008. p. 162. ISBN 9781588298942.
- Closs, G.L.; Calcaterra, L.T.; Green, N.J.; Penfield, K.W.; Miller, J.R. (1986). «Distance, stereoelectronic effects, and the Marcus inverted region in intramolecular electron transfer in organic radical anions». J. Phys. Chem. 90: 3673-3683. doi:10.1021/j100407a039.