Tetrafluoroborato de 1-butil-3-metilimidazolio
El tetrafluoroborato de 1-butil-3-metilimidazolio, también conocido como [bmim]BF4, es un líquido iónico. Está formado por un catión heterocíclico sustituido [bmin]+(1-butil-3-metilimidazolio) y un anión inorgánico [BF]4-(tetrafluoroborato).
| Tetrafluoroborato de 1-butil-3-metilimidazolio | ||
|---|---|---|
 | ||
| Nombre IUPAC | ||
| 1-butyl-3-methylimidazolium tetrafluoroborate | ||
| General | ||
| Otros nombres | [bmim]BF4 | |
| Fórmula molecular | C8H15BF4 N2 | |
| Identificadores | ||
| Número CAS | 174501-65-6[1] | |
| ChEMBL | CHEMBL3186788 | |
| ChemSpider | 2015934 | |
| PubChem | 2734178 | |
| UNII | T2TVZ2306T | |
| Propiedades físicas | ||
| Apariencia | líquido claro amarillento | |
| Densidad | 1200 kg/m³; 1,2 g/cm³ | |
| Masa molar | 22 602 g/mol | |
| Punto de fusión | 202,15 K (−71 °C) | |
| Punto de ebullición | 561,15 K (288 °C) | |
| Viscosidad | 279,86 mPa/s a 25 °C | |
| Índice de refracción (nD) | 1,4227 a 25 °C | |
| Propiedades químicas | ||
| Solubilidad en agua | inmiscible | |
| Termoquímica | ||
| Capacidad calorífica (C) | 1720 J/kg·K a 25 °C (liq) | |
| Peligrosidad | ||
| NFPA 704 |
1
2
0
| |
| Frases R | R22 R36 R37 R38 | |
| Frases S | S26 S37 S39 | |
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. | ||
Propiedades y aplicaciones
Entre sus características destaca que es un excelente disolvente,[2] tiene bajo punto de fusión, es estable en agua y aire, presenta una alta conductividad y posee un amplio rango de estabilidad electroquímica. Todo esto hace de este líquido iónico un perfecto candidato para catálisis, baterías, extracciones líquido-líquido,etc.[3]
Se utiliza como disolvente en reacciones de hidrogenación ya que permite el uso de catalizadores homogéneos (metales de transición), pudiendo separar fácilmente, el líquido iónico y el catalizador de los productos finales de la reacción.La hidrogenación del ciclohexano o la hidrogenación completa de anillos bencénicos son algunos ejemplos. Otra reacción importante en la que actúa como disolvente es en la obtención del naproxeno,de interés en la industria farmacéutica.
Síntesis
Para sintetizar el [bmim]BF4 existen muchas posiblidades:intercambio de aniones,neutralización, esterificación,entre otras. Todas estas reacciones se llevan a cabo a temperatura ambiente y se caracterizan por los largos tiempos de reacción.
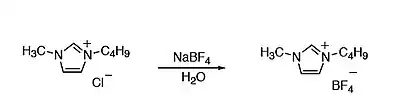
Una forma sencilla y la más utilizada es haciendo reaccionar cloruro de 1-butil-3-metilimidazolio con NaBF4 en disolución acuosa.[4]
Otra manera más novedosa es mediante síntesis por radiación con microondas,se obtienen mayores rendimientos y se evita el empleo de grandes cantidades de disolventes orgánicos y haluros de alquilo.[5]

Referencias
- Número CAS
- Anne-Laure Revelli,Fabrice Mutelet,Mireille Turmine, Roland Solimando and Jean-Noe¨l Jaubert. Activity Coefficients at Infinite Dilution of Organic Compounds in 1-Butyl-3-methylimidazolium Tetrafluoroborate Using Inverse Gas Chromatography. Journal of Chemical&Engineering Data,54:90–101,2009
- Ki-Sub Kim, Bae-Kun Shin and Huen Lee. Physical and Electrochemical Properties of 1-Butyl-3-methylimidazolium Bromide,1-Butyl-3-methylimidazolium Iodide, and 1-Butyl-3-methylimidazolium Tetrafluoroborate. Korean Journal of Chemical Engineering,21(5):1010-1014,2004
- Xavier Creary and Elizabeth D. Willis.Preparation of 1-butyl-3-methylimidazolium tetrafluoroborate[1H-Imidazolium, 1-butyl-3-methyl, tetrafluoroborate (1–)].Organic Syntheses,82:166-169 2005; Coll,11:859-861,2009
- Satoshi Horikoshi,Tomofumi Hamamura,Masatsugu Kajitani,Masahiro Yoshizawa-Fujita and Nick Serpone. Green Chemistry with a Novel 5.8-GHz Microwave Apparatus.Prompt One-Pot Solvent-Free Synthesis of a Major Ionic Liquid: The 1-Butyl-3-methylimidazolium Tetrafluoroborate System.Organic Process Research & Development,12:1089–1093,2008
Enlaces externos
Véase también
- Cloruro de 1-butil-3-metilimidazolio
- Hexafluorofosfato de 1-butil-3-metilimidazolio (en:1-Butyl-3-methylimidazolium hexafluorophosphate, en inglés)
