Tetrazepam
Tetrazepam es una benzodiazepina que actúa como ansiolítico y relajante muscular, en algunos países de Europa como España, Francia, Austria y Alemania es utilizado para tratar desórdenes de ansiedad como los ataques de pánico. En algunos raros casos es utilizado para tratar depresiones, síndromes premenstruales o agorafobias. El tetrazepam tiene un pequeño efecto sedativo en dosis bajas produciendo relajación muscular y control de la ansiedad.[2] Es frecuentemente utilizado para tratar contracturas e hipertonía muscular, la dosis indicada para espasmos musculares es de 50 mg. El 29 de abril de 2013, el Grupo de Coordinación para el Reconocimiento Mutuo y los Procedimientos Descentralizados (CMDh) de la Agencia Europea del Medicamento (EMA) ha recomendado la suspensión de comercialización de los medicamentos que contienen tetrazepam, por el riesgo de aparición de reacciones adversas cutáneas graves.[3]
| Tetrazepam | ||
|---|---|---|
 | ||
 | ||
| Nombre IUPAC | ||
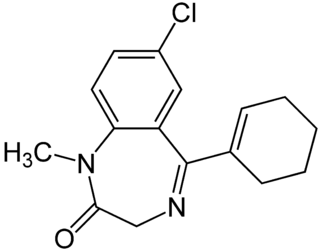
| 7-cloro-5-(ciclohexen-1-il)-1-metil-3H-1,4-benzodiazepin-2-ona | ||
| General | ||
| Fórmula estructural |
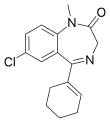 | |
| Fórmula molecular | C16H17N2ClO | |
| Identificadores | ||
| Número CAS | 10379-14-3[1] | |
| ChEBI | 135198 | |
| ChEMBL | CHEMBL2105527 | |
| ChemSpider | 23551 | |
| DrugBank | 13324 | |
| PubChem | 25215 | |
| UNII | FO92091VP8 | |
| KEGG | D07277 | |
|
Clc3cc\1c(N(C(=O)C/N=C/1/C2=C/CCCC2)C)cc3
| ||
| Propiedades físicas | ||
| Masa molar | 288,772 g/mol | |
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. | ||
Efectos adversos reportados:
La Agencia Francesa del Medicamento (Agence National de Sécurité du Medicament es des Produits de Santé - ANSM) inició una evaluación a raíz de la publicación de un caso de eczema reportado en el año 2011[4] En esta misma se describen los siguientes hallazgos:[4]
- 805 afecciones cutáneas de las cuales se evaluaron como graves 305 casos
- 59 casos de eritema multiforme polimorfo (1 caso de evolución fatal)
- 33 Casos de Síndrome de Stevens-Johnson (9 casos de evolución fatal)
- 33 casos de Síndrome de Lyell (1 caso de evolución fatal)
- 15 casos de Síndrome de hipersensibilidad medicamentosa (conocido como síndrome de DRESS) además de otros 3 casos etiquetados como posible DRESS;
- 5 casos de exantema pustuloso generalizado (y otro caso más etiquetado como posible)
- 67 casos de "otras" toxicodermias
- 118 casos de urticaria (de los cuales 21 fueron considerados como severos).
Según el mismo reporte (de la ANSM), no se describe reacción cruzada con otras benzodiacepinas. La agencia europea del medicamento (EMA) también ha recibido la evaluación procedente de las distintas agencias del medicamento de los estados miembros.[5]
La Agencia Española de Medicamentos y Productos Sanitarios (AEMPS) publicó con fecha 7 de junio de 2013, la suspensión de comercialización de Myolastan@ (Tetrazepam), único preparado con Tetrazepam disponible en España, siendo efectiva a partir del 1 de julio de 2013 .[6]
Véase también
Referencias
- Número CAS
- Human Metabolome Database. «Showing metabocard for Tetrazepam (HMDB0042029)» (en inglés). Consultado el 15 de febrero de 2019.
- European Medicines Agency (29 de abril de 2013). «Recommendation to suspend tetrazepam-containing medicines endorsed by CMDh» (en inglés). Consultado el 15 de febrero de 2019.
- «Extrait de la CNPV du 20/11/12 - Enquete sur les effets indesirables du tetrazepam - CRPV Bordeaux (11/01/2013)» (en francés). 20 de noviembre de 2012. Consultado el 28 de junio de 2013.
- «Assessment Report for Tetrazepam Containing Medicinal Products» (en inglés). 18 de abril de 2013. Consultado el 28 de junio de 2013.
- «Nota informativa de la Agencia Española de Medicamentos y Productos Sanitarios». 7 de junio de 2013. Consultado el 28 de junio de 2013.
Enlaces externos
- Grupo de Coordinación para el Reconocimiento Mutuo y los Procedimientos Descentralizados
- Tetrazepam en www.findrxonline.com
- Myolastan retirado de las farmacias españolas