Triflato
En química, el triflato, cuyo nombre sistemático es trifluorometanosulfonato, es un grupo funcional de fórmula CF3SO3-. El radical triflato se suele representar como -OTf, al contrario que -Tf, el cual designa al radical trifilo CF3SO2-. Así, la fórmula semidesarrollada del n-butiltriflato sería CH3CH2CH2CH2OTf.
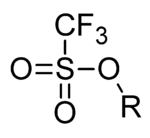
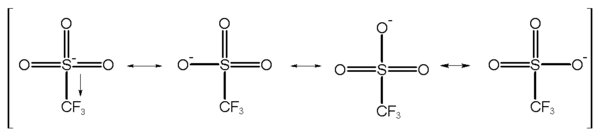
El anión triflato CF3SO3- es un anión poliatómico extremadamente estable, siendo su base conjugada, el ácido trifílico (CF3SO3H), uno de los ácidos más fuertes, conocido como superácido.
Aplicaciones
El grupo triflato es un excelente grupo saliente en algunas reacciones orgánicas, como la sustitución nucleofílica, los acoplamientos Suzuki y las reacciones de Heck. Ya que los alquiltriflatos son extremadamente reactivos en reacciones SN2, deben guardarse en un medio libre de nucleófilos, como el agua. La alta estabilidad de este anión se debe a la estabilización por resonancia, de modo que la carga negativa total se reparte entre los tres oxígenos y el átomo de azufre. Un componente de estabilización adicional lo da el grupo trifluorometilo, el cual es un excelente aceptor electrónico (tal es su capacidad de deslocalización que el ácido trifluoroacético CF3COOH es considerado el "ácido orgánico" más fuerte). Los triflatos de litio se utilizan en algunas baterías de ion-litio como un componente del electrólito.
Un agente triflante suave es la fenil-triflimida, o N,N-bis(trifluorometilsulfonil)anilina.
Sales de triflato
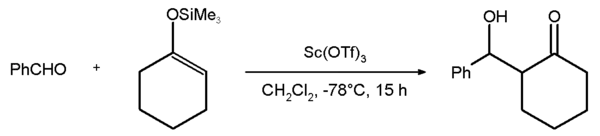
Las sales derivadas de los triflatos son muy estables térmicamente, con puntos de fusión tan elevados como 350 °C para contraiones sodio, boro y plata, especialmente en las variedades anhidras. Se pueden obtener directamente a partir del ácido trifílico como el hidróxido metálico o el carbonato metálico en agua. Los triflatos se usan como ácidos de Lewis en química orgánica, gracias a su mayor estabilidad frente a catalizadores tradicionales, que suelen ser menos estables en agua, como el cloruro de aluminio. Son especialmente útiles los triflatos derivados de lantánidos de tipo Ln(OTf)3 (donde Ln puede ser La, Ce, Pr, Nd, Sm, Eu, Gd, Tb, Dy, Ho, Er, Tm, Yb, Lu, Y). El triflato de escandio se usa en reacciones tipo Diels-Alder. En la figura inferior, se representa la reacción aldólica entre el benzaldehído y el silil-enoléter de la hexanona con un rendimiento de un 81%.[1] La misma reacción falla con una sal de itrio.
Véase también
- Ácido trifluorometanolsulfónico
- Superácido
- Nonaflato
 Wikimedia Commons alberga una categoría multimedia sobre Triflato.
Wikimedia Commons alberga una categoría multimedia sobre Triflato.
Referencias
- Shū Kobayashi: Scandium Triflate in Organic Synthesis. En: European Journal of Organic Chemistry 1/1999 p. 15-2