Trypanosoma brucei
Trypanosoma brucei es una especie de protista parásito que se encuentra principalmente en la sangre y puede invadir otros tejidos, incluyendo el sistema nervioso. Causa la tripanosomiasis africana (o enfermedad del sueño) en humanos y animales (nagana) en África. Hay tres subespecies de este parásito:
- T. b. gambiense, que causa la tripanosomiasis crónica de inicio lento.
- T. b. rhodesiense, que causa la tripanosomiasis aguda de inicio rápido.
- T. b. brucei, que causa la tripanosomiasis animal africana (o nagana), al igual que otras especies de tripanosomas.
| Trypanosoma brucei | ||
|---|---|---|
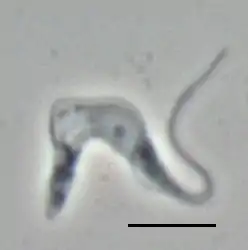 Trypanosoma brucei brucei TREU667 (forma sanguínea, imagen por contraste de fase), la barra mide 10 µm. | ||
 Entre glóbulos sanguíneos. | ||
| Taxonomía | ||
| Reino: | Protista | |
| (sin rango) | Excavata | |
| Filo: | Euglenozoa | |
| Clase: | Kinetoplastea | |
| Orden: | Trypanosomatida | |
| Familia: | Trypanosomatidae | |
| Género: | Trypanosoma | |
| Especie: | T. brucei | |
| Subespecies | ||
T. b. brucei | ||
La especie parasita dos huéspedes, un vector insecto (la mosca tse-tse) y un huésped mamífero. Debido a la gran diferencia entre estos dos huéspedes, la célula experimenta cambios complejos para facilitar su supervivencia en el intestino de los insectos y en la sangre de los mamíferos. Asimismo, cuenta con una única y notable cubierta de glicoproteína variante de superficie (VSG) con el fin de evitar al sistema inmunitario del huésped.
Mucha de la investigación sobre Trypanosoma brucei se realiza primero sobre Crithidia fasciculata, un organismo similar pero que no es peligroso para los seres humanos.
Trypanosoma brucei fue identificado por primera vez en 1895, por el patólogo David Bruce, como agente de la nagana y de la enfermedad del sueño. T. b. gambiense se describió primero, en 1902 por Joseph Everett Dutton. Ya en 1910, Stephens y Fantham, describieron T. b. rhodesiense.'[1]
Mecanismos de transmisión[2]
El mecanismo de transmisión más común es la picadura de la mosca tse-tse, la cual ingiere el parásito desde un animal infectado y, al picar al siguiente huésped, lo traspasa a este. No obstante, existen otras maneras de que la infección se propague:
- Infección madre - feto: el patógeno, presente en la madre, es capaz de traspasar la placenta . De este modo, el patógeno invadiría los tejidos del feto.
- A través de otros insectos succionadores. La mosca tse-tse no es el único vector posible de este patógeno.
- Infecciones accidentales en laboratorios en el tratamiento del microorganismo
- También se puede transmitir por contacto sexual
Etapas de infección[2]
Durante la infección del patógeno en un animal, se pueden diferenciar dos etapas:
- En la primera o etapa hemo-linfática, los microorganismos se multiplican en tejidos subcutáneos, sangre y linfa. En esta etapa, los individuos presentan fiebre, dolores de cabeza, agrandamiento de los nódulos linfáticos, dolor de articulaciones y picores.
- Más tarde, se pasa a una segunda etapa o etapa meningo-encefálica. Durante esta, el patógeno cruza la barrera sangre - cerebro y comienza a invadir el tejido del sistema nervioso central. Los síntomas son más graves y obvios, tales como cambios de humor y comportamiento, confusión, alteraciones sensoriales y falta de coordinación. También son importantes las alteraciones del ciclo del sueño, lo que da a esta enfermedad su nombre.
Distribución geográfica
Las dos subespecies de Trypanosoma brucei, causantes de la enfermedad del sueño, a la que es susceptible el ser humano, se distribuyen:[3]
- T. b. gambiense, en el oeste y en el centro de África.
- T. b. rhodesiense, en el este y en el centro de África.
Estructura de la célula
La estructura de la célula es la típica eucariota con todos los orgánulos, incluyendo núcleo, mitocondrias, retículo endoplasmático, aparato de Golgi etc. Entre las principales características inusuales se incluye una única gran mitocondria con una estructura de ADN mitocondrial condensada, en asociación con el cuerpo basal del flagelo, que inusualmente constituye el mecanismo de organización del citoesqueleto de la célula. La célula también presenta una densa cubierta de glicoproteína variante de superficie (VSG).
Los Trypanosoma se caracterizan por una morfología alargada, con un único flagelo que se extiende en la dirección del movimiento y que se mantiene unido al resto del cuerpo celular en gran parte de su longitud por una membrana. El núcleo es grande y ovalado. El tamaño de las células es variable, unos 18-42 µm de largo y 1-3 µm de ancho.

Las formas en las que se presenta T. brucei son las siguientes:
- Epimastigote. El cuerpo basal se encuentra en posición anterior al núcleo, con un flagelo largo conectado a lo largo del cuerpo celular.
- Tripomastigote. El cuerpo basal es posterior al núcleo, con un flagelo largo conectado a lo largo del cuerpo celular.
T. brucei se presenta usualmente en la forma tripomastigote y se diferencia en epimastigote proliferativa en las glándulas salivares de los insectos. A diferencia de Leishmania, las formas promastigote y amastigote no forman parte del ciclo vital de T.brucei.
La forma tripomastigote, a su vez, se diferencia en cuatro subtipos:
- Procíclico, presente en el intestino de la mosca, proliferativo.
- Metacíclico, en las glándulas salivares de la mosca, no proliferativo.
- Esbelto (slender), en el flujo sanguíneo del hombre, proliferativo.
- Corto (stumpy), en el flujo sanguíneo del hombre, preadaptado a la mosca tse-tse, no proliferativo.
El ciclo vital comprende las siguientes etapas:
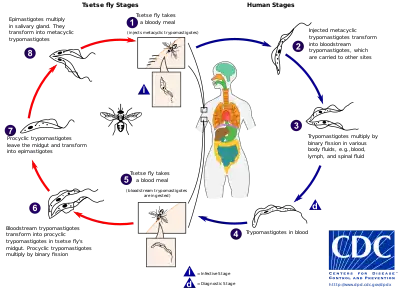
- Etapas en el ser humano. La mosca tse-tse inyecta tripomastigotes metacíclicos en el flujo sanguíneo del huésped al realizar una picadura (1 en la figura). Estos se transforman en tripomastigotes sanguíneos esbeltos y se multiplican por fisión binaria en varios fluidos del cuerpo: sangre, linfa, líquido cefalorraquídeo, etc (2, 3). Algunos se transforman en tripomastigotes sanguíneos cortos preadaptados a la mosca tse-tse (4).
- Etapas en la mosca tse-tse. Cuando una mosca pica a un huésped infectado, los tripomastigotes cortos pasan al sistema digestivo de la mosca (5). En el intestino de la mosca se transforman en tripomastigotes procíclicos y se multiplican por fisión binaria (6). A continuación, abandonan el intestino y se convierten en epimastigotes (7). Estos se multiplican en las glándulas salivares y se transforman en tripomatigotes metacíclicos. Si la mosca pica al hombre, se inyectan los tripomatigotes metacíclicos y el ciclo se completa (1).
Para poder adaptarse a los cambios ambientales que suponen las diferentes etapas de su ciclo vital, T. brucei presenta características metabólicas inusuales, así como cambios en su metabolismo durante el ciclo.[4]
Entre las características únicas de este patógeno, podemos destacar:
- Contienen una única mitocondria. Durante su etapa procíclica, presenta una estructura ramificada definida con crestas discoides. En cambio, las formas presentes en la sangre del mamífero muestran una estructura tubular estrecha menos desarrollada, con una morfología de acristato.
- Presentan orgánulos similares a peroxisomas (glicosomas), en los cuales se pueden encontrar enzimas glucolíticas. Es probable que estos orgánulos sean autofagocitados en la diferenciación a forma procíclica para que nuevos glicosomas con diferente contenido enzimático se produzcan. Así, los parásitos pueden adaptarse más rápido al nuevo hábitat.
- Cuenta con rutas metabólicas específicas y enzimas únicas. La citocromo oxidasa típica de la cadena de transporte electrónico de mamíferos no es la única para realizar este proceso. Adicionalmente, el patógeno en su forma esbelta contiene la terminal oxidasa, tiene una estructura y mecanismo de actuación típicos de plantas.
- Por último, es el único organismo que produce los tres tipos de esfingolípidos (esfingomielina, inositofosfoceramida y etanolamina), importantes en reconocimiento celular y la transmisión de la señal. Para ello, contiene cuatro esfingolípido sintasas (SLS), las cuales se encuentran en secuencias en tándem en el genoma.
Los protozoos flagelados se multiplican por fisión binaria y su medio de movimiento son orgánulos de locomoción. Su motilidad es vigorosa debido a la eficiencia de su aparato locomotor, el flagelo. En algunos flagelados, como los tripanosomas, el flagelo llega a formar parte de la superficie celular y crea una estructura llamada membrana ondulante. El movimiento ocurre en ondas helicoidales y parece ser idóneo para microorganismos que viven dentro de un ambiente líquido viscoso, como el del torrente sanguíneo. Si bien varios géneros flagelados parasitan a humanos, sólo cuatro causan enfermedad, entre ellos Trypanosoma.
Se ha visto también, que el patógeno es capaz de adaptar su metabolismo a los distintos ambientes. Así, en el intestino medio de la mosca, usan prolina como fuente primaria de carbono. En este ambiente, los aminoácidos son muy abundantes. Cuando el parásito invade un mamífero y se encuentra en la sangre, la fuente de carbono primaria pasa a ser la glucosa. Por último, estudios recientes han confirmado que este microorganismo es capaz de invadir tejido adiposo. Se han encontrado parásitos en tejido adiposo gonadal, mediastínico, mesentérico, retroperitoneal, perirrenal y interescapular.[5] En ellos, la fuente de energía son los lípidos; para aprovecharla, T. brucei es capaz de cambiar su metabolismo y comenzar a realizar la β-oxidación de los ácidos grasos.
Genoma
El genoma de T. brucei consta de:
- 11 cromosomas largos con una longitud de 1 a 6 millones de pares de bases.
- 6 cromosomas intermedios con de 300 a 600 millares de pares de bases.
- Alrededor de 100 mini-cromosomas con aproximadamente 50 a 100 millares de pares de bases que pueden presentarse en múltiples copias por genoma haploide.
Los cromosomas largos contienen genes, mientras que los pequeños tienden a llevar genes implicados en la variación antigénica, incluidos los genes de VSG. El genoma ha sido secuenciado y está disponible en www.genedb.org.
El genoma mitocondrial se encuentra condensado en el cinetoplasto, una inusual característica única de la clase Kinetoplastea. El cinetoplasto y el cuerpo basal del flagelo están fuertemente asociados a través de la estructura del citoesqueleto.
La cubierta VSG
La superficie de la célula de los tripanosomas se compone de una capa uniforme de glicoproteína variante de superficie (VSG). Esta capa tiene dos funciones:
- Una barrera física que bloquea el reconocimiento de la célula por el sistema inmune específico del mamífero huésped y oculta las proteínas invariantes de la superficie (como los canales iónicos, receptores, etc) al reconocimiento del sistema inmunitario.
- Una superficie variable para la célula, lo que permite la variación y adaptación específica para evitar al sistema inmunitario.
Se cree que esta capa, altamente variable, es codificada por varios cientos de copias alternativas de un gen en el genoma. En cada célula, y en toda una población de células en el huésped, se expresa la misma capa de proteínas, pero esta expresión es inestable y es probable que cambie con la próxima generación. Se han apreciado tasas de conmutación de hasta 1 por cada 50 células en una generación.
La proteína se compone de un dominio terminal N muy variable de alrededor de 300 a 350 aminoácidos, y un dominio terminal C más conservativo de unos 100 aminoácidos. El dominio terminal C forma un paquete estructural de 4 hélices alfa, mientras que el dominio terminal N de dominio forma un 'halo' alrededor de las hélices. La estructura terciaria de este halo es bastante constante (sorprendente, dado que las secuencias de aminoácidos varían mucho), lo que permite el empaquetamiento próximo que se requiere para la formación de la barrera física VSG. La VSG se ancla a la membrana celular por medio de un ancla GPI, un enlace covalente del terminal C, a través de alrededor de 4 azúcares, al ácido fosfatidilcolina-inositol fosfolípido de la membrana celular.
El genoma contiene múltiples copias del gen que codifica las VSG. Alrededor de 20 se encuentran en los cromosomas largos e intermedios que están activos y potencialmente transcritos (aunque sólo uno por célula). Alrededor de 100 se encuentran cerca de los telómeros de los mini-cromosomas. Estos no están activos, pero si a través de una recombinación se traslada a un lugar de transcripción activa, producirá una proteína VSG funcional. Por último, alrededor de 1000 se encuentran en secciones repetidas en el interior de los cromosomas. Estos están generalmente inactivos, debido a secciones omitidas o codones de parada prematura, pero son importantes en la evolución de nuevos genes VSG. Se calcula que hasta un 10% del genoma T. brucei podría estar compuesto por genes o pseudogenes VSG.
Tras la infección, el tripanosoma expresa una VSG en particular. Como el sistema inmunitario del huésped genera una respuesta concreta a esta capa de proteínas, se producirá una disminución de la población de tripanosomas. En este punto, una célula que exprese una VSG alternativa será fuertemente seleccionada y repoblará la infección. El efecto general de este ciclo de proliferación y decaimiento de la población debido al ciclo de la relación predador/presa con el sistema inmunitario del huésped da lugar a una sucesión de episodios de infección, cada uno debido a una población con diferentes expresiones de cubiertas VSG.
Referencias
- A. Zeibig, Elisabeth (2013). «5: The hemoflagellates». Clinical Parasitology: A practical Approach. Elsevier. p. 120-123.
- «Trypanosomiasis, human African (sleeping sickness)». www.who.int (en inglés). Consultado el 9 de diciembre de 2020.
- International Glossina Genome Initiative (2014). «Genome Secuence of the Tsetse Fly (Glossina morsitans): Vector of African Trypanosomiasis». Science. doi:10.1126/science.1249656.
- Smith, Terry K.; Bringaud, Frédéric; Nolan, Derek P.; Figueiredo, Luisa M. (18 de mayo de 2017). «Metabolic reprogramming during the Trypanosoma brucei life cycle». F1000Research (en inglés) 6: 683. ISSN 2046-1402. PMC 5461901. PMID 28620452. doi:10.12688/f1000research.10342.2. Consultado el 9 de diciembre de 2020.
- Trindade, Sandra; Rijo-Ferreira, Filipa; Carvalho, Tânia; Pinto-Neves, Daniel; Guegan, Fabien; Aresta-Branco, Francisco; Bento, Fabio; Young, Simon A. et al. (2016-06). «Trypanosoma brucei Parasites Occupy and Functionally Adapt to the Adipose Tissue in Mice». Cell Host & Microbe 19 (6): 837-848. ISSN 1931-3128. PMC 4906371. PMID 27237364. doi:10.1016/j.chom.2016.05.002. Consultado el 9 de diciembre de 2020.
7. K. Gull (1999). "The Cytoskeleton of Trypanosomatid Parasites". Annual Review of Microbiology 53: 629-655. PMID 10547703.
8. Kenneth J. Ryan, C. George Ray. (2017). Sherris. Microbiología Médica, 6e https://accessmedicina.mhmedical.com/content.aspx?bookid=2169§ionid=162986222