Tubo de RMN
Un tubo de RMN es un tubo de vidrio de paredes delgadas utilizado para contener las muestras en la espectroscopia de resonancia magnética nuclear (RMN). Normalmente los tubos de RMN poseen 5 mm de diámetro, pero los de 10 mm y 3 mm también son usados. Es importante que los tubos sean de grosor uniforme y estén equilibrados para asegurar que el tubo de RMN rota a una velocidad normal (es decir, que no fluctúe), por lo general giran en el espectrómetro de RMN a unos 20 Hz.

Características
Los tubos de RMN se fabrican habitualmente con vidrio de borosilicato. Están disponibles en longitudes de siete y ocho pulgadas, con un diámetro de tubo exterior de 5 mm por lo común, aunque también están disponibles tubos con diámetros externos de 3 mm y 10 mm. En caso de que vayamos a hacer RMN de boro, emplearemos tubos de RMN de cuarzo que contienen bajas concentraciones de boro (en lugar de vidrio borosilicato). Podemos encontrar cierres especializados tales como las válvulas J. Young y de tapón de rosca junto a los habituales tapones de polietileno.
Dos especificaciones habituales para los tubos de RMN son la concentricidad y la comba. La concentricidad se refiere a la variación en los centros radiales, medido en las paredes interiores y exteriores. La comba se refiere a la "rectitud" del tubo.[1] Tubos con valores bajos para ambos parámetros pueden causar espectros de calidad más pobre reduciendo la homogeneidad de la muestra. En particular, un tubo de RMN que tiene un bajo valor de comba puede tambalearse cuando gira, dando lugar a bandas laterales de giro.
Preparación de las muestras
Por lo general, solo se disuelve una pequeña muestra en un disolvente apropiado.[2] Para experimentos de RMN 1H, se suele emplear un disolvente deuterado como CDCl3 (triclorometano deuterado). Se debe emplear suficiente cantidad de disolvente con el fin de llenar el tubo de 4-5 cm (dependiendo del espectrómetro). La técnica RMN de proteínas se realiza generalmente en una mezcla 90% de H2O (o tampón) / 10% mezcla de D2O.
La muestra puede ser sonicada (dispersada con ultrasonidos)[3] o agitada para facilitar su disolución, y los sólidos se eliminan a través de filtrado mediante un tapón de celite en una pipeta Pasteur, directamente en el tubo de RMN.
El tubo de RMN es entonces por lo general sellado con un tapón de polietileno, pero puede ser también sellado a la llama o cerrado con una llave de ''Schlenk'' de teflón o incluso una membrana de goma muy pequeña. El parafilm se puede envolver alrededor del tapón para reducir la evaporación del disolvente.
Tubos Shigemi
Un tubo Shigemi es un tubo de RMN de tamaño microescala que se utiliza con un tubo de RMN de tamaño normal. Los tubos Shigemi puede ser apropiados para experimentos de RMN de proteínas, donde solo tenemos disponible una muestra muy pequeña. Se desea mantener un menor volumen del correspondiente disolvente para conseguir una mayor concentración de la muestra. La profundidad reducida de la muestra se ve compensada con vidrio sólido en el tubo de RMN por debajo del nivel de la muestra, la cual varía según la marca del espectrómetro. Una vez que las burbujas de aire han sido expulsadas, el émbolo se asegura al tubo propiamente dicho con parafina. Idealmente, los tubos se hacen coincidir con el disolvente deuterado utilizado para tener una mejor resolución del espectro.[4]
 Émbolo/Centro de inserción. A la izquierda tubo externo de 8 mm "de longitud inferior" apropiado para espectrómetros de RMN Bruker y Varian. A la derecha tubo externo de 15 mm apropiado sólo para espectrómetro Varian
Émbolo/Centro de inserción. A la izquierda tubo externo de 8 mm "de longitud inferior" apropiado para espectrómetros de RMN Bruker y Varian. A la derecha tubo externo de 15 mm apropiado sólo para espectrómetro Varian Tubo Shigemi de 8 mm totalmente montado, con inserción segura al tubo exterior con parafilm
Tubo Shigemi de 8 mm totalmente montado, con inserción segura al tubo exterior con parafilm Primer plano de la muestra que se extiende entre las marcas insertar y "longitud inferior"
Primer plano de la muestra que se extiende entre las marcas insertar y "longitud inferior"
Limpieza


Los tubos de RMN son difíciles de limpiar debido a su pequeño diámetro. Deben ser limpiados antes de que la muestra se haya secado.
La limpieza se realiza generalmente mediante lavado con el mismo solvente (no deuterado) usado para disolver la muestra inicial. El diclorometano o la acetona son buenas opciones porque el diclorometano es similar en polaridad al cloroformo, un disolvente común usado en RMN, mientras que la acetona disuelve muchos compuestos orgánicos. La sonicación y el frotamiento con una escobilla limpiadora de tubos puede ser útil en la eliminación de restos de contaminantes sólidos. Si es necesario, el tubo puede ser llenado con una disolución oxidante de agua regia o con disolución piraña (H2O2/H2SO4). Las disoluciones de ácido crómico nunca se usan, debido a que dejan trazas de cromo paramagnético en los tubos que provocan interferencias con los experimentos de RMN.[5]
Cuando se determina que el tubo de RMN está limpio, se hace un triple enjuagado con agua destilada, acetona, y se deja secar al aire seco o en un horno a alta temperatura.
Limpiador de tubos de RMN
Una mejor alternativa a la utilización de oxidantes potencialmente peligrosos es un limpiador de tubos de RMN (izquierda). Es un aparato que utiliza el vacío para eliminar los disolventes y/o una disolución detergente que limpia completamente el tubo de RMN.
En este aparato, el tubo de RMN 1 (con el tapón 3 fijado a la base del tubo de RMN), se coloca boca abajo. El tubo de RMN se coloca en un tubo interior 5 unido al depósito de disolvente 6. El tapón del tubo de RMN se queda en el tubo exterior del aparato 4. Se aplica vacío (por lo general a través de la toma de aspiración de una trompa de agua). La tapa del tubo de RMN forma un sellado de vacío. El disolvente 7 se extrae del depósito de disolvente 6, se conduce forzado a la base del tubo de RMN y enjuaga el tubo de RMN a fin de limpiarlo. Téngase en cuenta que, para completar el vacío, un matraz se conecta al aparato de limpieza del tubo de RMN.
Este tipo de aparato está disponible comercialmente,[6] a pesar de que es costoso y fácil de destruir por rotura del tubo de limpieza. Otros diseños equivalentes pueden ser montados a partir de material de laboratorio corriente.[7][8]
Galería
 Una muestra de politiofenos en un tubo de RMN. Debido al alto grado de conjugación, la muestra emite fluorescencia bajo luz ultravioleta.
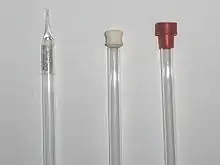
Una muestra de politiofenos en un tubo de RMN. Debido al alto grado de conjugación, la muestra emite fluorescencia bajo luz ultravioleta. 3 tubos de RMN, sellados.
3 tubos de RMN, sellados. Tapón de teflón usado para sellar tubos de RMN correspondientes a muestras sensibles al aire: posee un agujero central que empieza en su parte superior, que se divide en una unión en T en la parte inferior. Una de las aperturas de la T invertida está visible en la fotografía.
Tapón de teflón usado para sellar tubos de RMN correspondientes a muestras sensibles al aire: posee un agujero central que empieza en su parte superior, que se divide en una unión en T en la parte inferior. Una de las aperturas de la T invertida está visible en la fotografía. Tubo de RMN de la marca J. Young conectado a un adaptador con una unión hembra ya engrasada. Hótese el agujero resultante del taladro en forma de T junto a la conexión de PTFE.
Tubo de RMN de la marca J. Young conectado a un adaptador con una unión hembra ya engrasada. Hótese el agujero resultante del taladro en forma de T junto a la conexión de PTFE. Vista superior de un tubo de RMN de la marca J. Young mostrando el agujero que conduce al taladro en forma de T.
Vista superior de un tubo de RMN de la marca J. Young mostrando el agujero que conduce al taladro en forma de T.
Referencias
- https://web.archive.org/web/20110714190050/http://www.nmrtubes.com/technical_faqs.html
- Laurence M. Harwood, Christopher J. Moody (13 de junio de 1989). Experimental organic chemistry: Principles and Practice (Illustrated edition edición). WileyBlackwell. p. 318–321
|página=y|páginas=redundantes (ayuda). ISBN 978-0632020171. - Fraccionamiento subcelular. Manuel Reina. Universidad de Barcelona.
- «Shigemi NMR Microtube Assemblies». Sigma-Aldrich. Consultado el 27 de junio de 2008.
- «NMR-010: Proper Cleaning Procedures for NMR Sample Tubes». Wilmad. Archivado desde el original el 13 de mayo de 2008. Consultado el 27 de junio de 2008.
- «Aldrich NMR Tube Cleaners». Sigma-Aldrich. Consultado el 27 de junio de 2008.
- «NMR Tube Cleaner and Drier». Torviq. Archivado desde el original el 13 de diciembre de 2006. Consultado el 27 de junio de 2008.
- Karsten Alstad Sørbye (29 de septiembre de 2005). «NMR Tube Washer». spectroscopyNOW.com. Consultado el 27 de junio de 2008.