Vacuna MTBVAC
MTBVAC es la única vacuna candidata contra la tuberculosis en ensayos clínicos basados en una forma genéticamente modificada del patógeno Mycobacterium tuberculosis aislado de humanos. A diferencia de la BCG, MTBVAC contiene todos los antígenos presentes en las cepas que infectan a los humanos. Esta vacuna fue construida en la Universidad de Zaragoza en el laboratorio del Grupo de Genética Micobacteriana, que forma parte del CIBERES desde el inicio del proyecto, en colaboración con la Dra. Brigitte Gicquel del Instituto Pasteur de París. Actualmente, la Universidad de Zaragoza tiene como socio industrial: la empresa española de biotecnología BIOFABRI, perteneciente al grupo ZENDAL, responsable del desarrollo industrial y clínico de MTBVAC, estudiando su inmunidad y seguridad en dos ensayos Fase 2a en recién nacidos y adultos en Sudáfrica. Se espera que los estudios de eficacia de la vacuna comiencen en 2022. Para el Desarrollo Clínico de MTBVAC, el proyecto de vacuna tuberculosis cuenta con el asesoramiento y apoyo de las organizaciones internacionales la Europea TBVI (Tuberculosis Vaccine Initiative) desde 2008 y la de Estados Unidos, IAVI (International Aids Vaccine Initiative) desde 2016
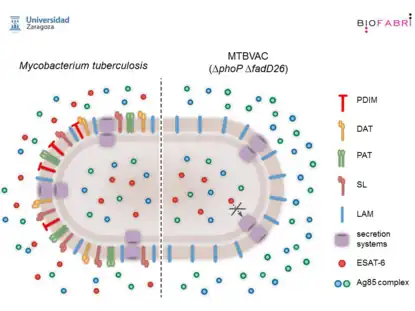
Construcción y caracterización molecular de MTBVAC
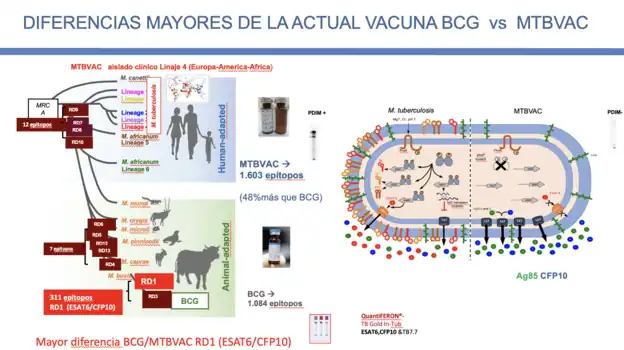
El descubrimiento de MTBVAC sigue los principios de vacunación de Pasteur: aislamiento del patógeno humano, atenuación por inactivación racional de genes seleccionados, estudios de protección en modelos animales y evaluación en humanos. La atenuación racional de MTBVAC se logró mediante la inactivación de los genes phoP y fadD26 [1], siguiendo la normativa internacional para el desarrollo clínico de vacunas vivas de tuberculosis[2]. Similar a BCG, que fue concebido a principios de la década de 1900 como una cepa atenuada de Mycobacterium bovis que causa tuberculosis (TB) en vacas transmitida a humanos principalmente a través de la ingestión de leche no pasteurizada, el descubrimiento de MTBVAC comienza con un brote inusual de muerte de M. bovis resistente a múltiples fármacos. más de 100 personas con VIH en España a principios de la década de 1990[3]. A partir de ese brote, el profesor Carlos Martín Montañés y su grupo identificaron al gen phoP como un actor clave en la virulencia de M. tuberculosis[4]. El gen phoP codifica el factor de transcripción PhoP del sistema de dos componentes PhoP / PhoR esencial para la virulencia de M. tuberculosis [4][5]. Se demostró que PhoP regula entre el 2 y el 4% de los genes de M. tuberculosis, la mayoría de los cuales participan en vías de virulencia bien conocidas del bacilo de la tuberculosis[6][7][8]. Como consecuencia de la inactivación de phoP, MTBVAC puede producir, pero no puede exportar, ESAT-6, lo que da como resultado una atenuación de la virulencia, pero mantiene los epítopos presentes en esta proteína inmunogénica [9]. Otros genes de virulencia relevantes regulados por PhoP están involucrados en la biosíntesis de las aciltrehalosas derivadas de policétidos (DAT, PAT) y los sulfolípidos (SL), que son constituyentes lipídicos de primera línea de la pared celular que se cree que desempeñan un papel en la modulación inmunitaria del huésped, lo que interfiere con el reconocimiento de M. tuberculosis por el sistema inmunitario [10],[11]. Finalmente, PhoP es capaz de modular la secreción de proteínas, y la inactivación de phoP en MTBVAC da como resultado una mayor secreción de proteínas inmunogénicas como el complejo Ag85 [6], ver Figura MTBVAC. El gen fadD26 es el primer gen de un operón necesario para la biosíntesis y exportación de dicocerosatos de Tiocerol (PDIM), los principales lípidos de la pared celular asociados a la virulencia de M. tuberculosis [12],[13]. La evidencia reciente indica que PDIM están involucrados en la ruptura fagosomal en concierto con ESAT-6[14].
Caracterización preclínica de MTBVAC
La principal ventaja de utilizar vacunas vivas basadas en la atenuación racional de M. tuberculosis es su capacidad para mantener el repertorio genético que codifica antígenos inmunodominantes ausentes en BCG[15], mientras que las deleciones cromosómicas en los genes de virulencia garantizan la seguridad y la estabilidad genética. Se espera que dichas vacunas induzcan de forma segura respuestas inmunitarias más específicas y duraderas en humanos que pueden proporcionar protección contra todas las formas de la enfermedad. Este es el razonamiento que se ha seguido en el desarrollo del MTBVAC atenuado en vivo. Los estudios preclínicos rigurosos en diferentes modelos animales relevantes para la tuberculosis (en ratones, cobayas y primates no humanos) realizados entre 2001 y 2011 han demostrado una atenuación adecuada, seguridad y una inmunogenicidad mejorada y eficacia protectora contra la exposición a M. tuberculosis en comparación con BCG, por lo que el cumplimiento de las directrices reglamentarias de la OMS y los requisitos del consenso de Ginebra para el progreso de las vacunas micobacterianas vivas a la primera evaluación clínica de Fase 1 en humanos [1][2][16].
Ensayos clínicos de seguridad, inmunogenicidad y eficacia de MTBVAC
Antes de llegar a la fase de evaluación de la eficacia, cualquier vacuna debe someterse a varios ensayos clínicos separados en dos fases para determinar la seguridad e inmunogenicidad de la vacuna. En este sentido, se realizan los primeros ensayos de Fase 1 (generalmente con menos de 100 voluntarios) para establecer la seguridad (y la inmunogenicidad mínima) de la vacuna cuando se administra por primera vez en una población determinada. Los estudios de Fase 1 exitosos son seguidos por ensayos de Fase 2 de tamaño mediano (que incluyen 100 o más voluntarios en total) realizados para confirmar la seguridad, ampliar la inmunogenicidad y definir la dosis de la vacuna necesaria para la evaluación de la eficacia en los ensayos de Fase 3.
En el caso particular de MTBVAC, tras la finalización con éxito de su primer ensayo de Fase 1a en humanos en adultos en Suiza (2012-2014) (NCT02013245)[17], MTBVAC se evaluó con éxito en un estudio de Fase 1b de aumento de dosis Sudáfrica en recién nacidos sanos no expuestos al VIH por la Iniciativa de Vacuna contra la Tuberculosis de Sudáfrica (SATVI) (NCT02729571) [18]. El ensayo en recién nacidos confirmó la seguridad de la vacuna y una mayor inmunogenicidad en comparación con BCG, lo que sugiere el contenido antigénico más amplio de MTBVAC. MTBVAC está completando dos ensayos de Fase 2 de definición de dosis en Sudáfrica en SATVI, utilizando BCG como control de referencia: uno en adolescentes y adultos vacunados con BCG con y sin infección previa por M. tuberculosis (NCT02933281) (completado en septiembre de 2021) otro en recién nacidos (NCT03536117) (se espera que finalice en marzo de 2022).
La definición de la dosis de MTBVAC en recién nacidos permitirá su entrada en estudios de eficacia de Fase 3 ya planificados en regiones endémicas de TB de alta carga de África subsahariana. Con este fin, el proyecto MTBVAC recibió recientemente una financiación parcial del EDCTP ([19] European and Developing Countries Clinical Trials) que apoya la evaluación multicéntrica de la eficacia de la Fase 3 en recién nacidos en Sudáfrica (en diferentes centros clínicos), Madagascar y Senegal. Ahora se estima que la Fase 3 iniciará el segundo trimestre de 2022 para dar cuenta de los retrasos en los ensayos de Fase 2 causados por la pandemia COVID-19 en 2020. El ensayo de Fase 3 está registrado en ClinicalTrials.gov, NCT04975178.

Referencias
- Arbues, Ainhoa; Aguilo, Juan I.; Gonzalo-Asensio, Jesus; Marinova, Dessislava; Uranga, Santiago; Puentes, Eugenia; Fernandez, Conchita; Parra, Alberto et al. (2013-10). «Construction, characterization and preclinical evaluation of MTBVAC, the first live-attenuated M. tuberculosis-based vaccine to enter clinical trials». Vaccine (en inglés) 31 (42): 4867-4873. doi:10.1016/j.vaccine.2013.07.051. Consultado el 13 de diciembre de 2021.
- Kamath, Arun T.; Fruth, Uli; Brennan, Michael J.; Dobbelaer, Roland; Hubrechts, Peter; Ho, Mei Mei; Mayner, Ronald E.; Thole, Jelle et al. (2005-05). «New live mycobacterial vaccines: the Geneva consensus on essential steps towards clinical development». Vaccine (en inglés) 23 (29): 3753-3761. doi:10.1016/j.vaccine.2005.03.001. Consultado el 13 de diciembre de 2021.
- Rivero, A.; Marquez, M.; Santos, J.; Pinedo, A.; Sanchez, M. A.; Esteve, A.; Samper, S.; Martin, C. (1 de enero de 2001). «High Rate of Tuberculosis Reinfection during a Nosocomial Outbreak of Multidrug-Resistant Tuberculosis Caused by Mycobacterium bovis Strain B». Clinical Infectious Diseases (en inglés) 32 (1): 159-161. ISSN 1058-4838. doi:10.1086/317547. Consultado el 13 de diciembre de 2021.
- Pérez, Esther; Samper, Sofía; Bordas, Yann; Guilhot, Christophe; Gicquel, Brigitte; Martín, Carlos (21 de diciembre de 2001). «An essential role for phoP in Mycobacterium tuberculosis virulence». Molecular Microbiology 41 (1): 179-187. ISSN 0950-382X. doi:10.1046/j.1365-2958.2001.02500.x. Consultado el 13 de diciembre de 2021.
- Walters, Shaun B.; Dubnau, Eugenie; Kolesnikova, Irina; Laval, Francoise; Daffe, Mamadou; Smith, Issar (2006-04). «The Mycobacterium tuberculosis PhoPR two-component system regulates genes essential for virulence and complex lipid biosynthesis». Molecular Microbiology 60 (2): 312-330. ISSN 0950-382X. doi:10.1111/j.1365-2958.2006.05102.x. Consultado el 13 de diciembre de 2021.
- Solans, Luis; Gonzalo-Asensio, Jesús; Sala, Claudia; Benjak, Andrej; Uplekar, Swapna; Rougemont, Jacques; Guilhot, Christophe; Malaga, Wladimir et al. (29 de mayo de 2014). «The PhoP-Dependent ncRNA Mcr7 Modulates the TAT Secretion System in Mycobacterium tuberculosis». PLoS Pathogens 10 (5): e1004183. ISSN 1553-7374. doi:10.1371/journal.ppat.1004183. Consultado el 13 de diciembre de 2021.
- Broset, Esther; Martín, Carlos; Gonzalo-Asensio, Jesús (30 de octubre de 2015). «Evolutionary Landscape of the Mycobacterium tuberculosis Complex from the Viewpoint of PhoPR: Implications for Virulence Regulation and Application to Vaccine Development». mBio (en inglés) 6 (5). ISSN 2161-2129. PMC 4620462. PMID 26489860. doi:10.1128/mBio.01289-15. Consultado el 13 de diciembre de 2021.
- Gonzalo-Asensio, J.; Malaga, W.; Pawlik, A.; Astarie-Dequeker, C.; Passemar, C.; Moreau, F.; Laval, F.; Daffe, M. et al. (21 de julio de 2014). «Evolutionary history of tuberculosis shaped by conserved mutations in the PhoPR virulence regulator». Proceedings of the National Academy of Sciences 111 (31): 11491-11496. ISSN 0027-8424. doi:10.1073/pnas.1406693111. Consultado el 13 de diciembre de 2021.
- Frigui, Wafa; Bottai, Daria; Majlessi, Laleh; Monot, Marc; Josselin, Emmanuelle; Brodin, Priscille; Garnier, Thierry; Gicquel, Brigitte et al. (15 de febrero de 2008). «Control of M. tuberculosis ESAT-6 Secretion and Specific T Cell Recognition by PhoP». PLoS Pathogens 4 (2): e33. ISSN 1553-7374. doi:10.1371/journal.ppat.0040033. Consultado el 13 de diciembre de 2021.
- Chesne-Seck, Marie-Laure; Barilone, Nathalie; Boudou, Frédéric; Asensio, Jesús Gonzalo; Kolattukudy, Pappachan E.; Martín, Carlos; Cole, Stewart T.; Gicquel, Brigitte et al. (15 de febrero de 2008). «A Point Mutation in the Two-Component Regulator PhoP-PhoR Accounts for the Absence of Polyketide-Derived Acyltrehaloses but Not That of Phthiocerol Dimycocerosates in Mycobacterium tuberculosis H37Ra». Journal of Bacteriology 190 (4): 1329-1334. ISSN 0021-9193. doi:10.1128/jb.01465-07. Consultado el 13 de diciembre de 2021.
- Asensio, Jesús Gonzalo; Maia, Catarina; Ferrer, Nadia L.; Barilone, Nathalie; Laval, Françoise; Soto, Carlos Yesid; Winter, Nathalie; Daffé, Mamadou et al. (2006-01). «The Virulence-associated Two-component PhoP-PhoR System Controls the Biosynthesis of Polyketide-derived Lipids in Mycobacterium tuberculosis». Journal of Biological Chemistry 281 (3): 1313-1316. ISSN 0021-9258. doi:10.1074/jbc.c500388200. Consultado el 13 de diciembre de 2021.
- Cox, Jeffery S.; Chen, Bing; McNeil, Michael; Jacobs, William R. (1999-11). «Complex lipid determines tissue-specific replication of Mycobacterium tuberculosis in mice». Nature 402 (6757): 79-83. ISSN 0028-0836. doi:10.1038/47042. Consultado el 13 de diciembre de 2021.
- Camacho, Luis R.; Constant, Patricia; Raynaud, Catherine; Lanéelle, Marie-Antoinette; Triccas, James A.; Gicquel, Brigitte; Daffé, Mamadou; Guilhot, Christophe (2001-01). «Analysis of the Phthiocerol Dimycocerosate Locus ofMycobacterium tuberculosis». Journal of Biological Chemistry 276 (23): 19845-19854. ISSN 0021-9258. doi:10.1074/jbc.m100662200. Consultado el 13 de diciembre de 2021.
- Augenstreich, Jacques; Arbues, Ainhoa; Simeone, Roxane; Haanappel, Evert; Wegener, Alice; Sayes, Fadel; Le Chevalier, Fabien; Chalut, Christian et al. (15 de febrero de 2017). «ESX-1 and phthiocerol dimycocerosates ofMycobacterium tuberculosisact in concert to cause phagosomal rupture and host cell apoptosis». Cellular Microbiology 19 (7): e12726. ISSN 1462-5814. doi:10.1111/cmi.12726. Consultado el 13 de diciembre de 2021.
- Brosch, R.; Gordon, S. V.; Marmiesse, M.; Brodin, P.; Buchrieser, C.; Eiglmeier, K.; Garnier, T.; Gutierrez, C. et al. (12 de marzo de 2002). «A new evolutionary scenario for theMycobacterium tuberculosiscomplex». Proceedings of the National Academy of Sciences 99 (6): 3684-3689. ISSN 0027-8424. doi:10.1073/pnas.052548299. Consultado el 13 de diciembre de 2021.
- Martín, Carlos; Marinova, Dessislava; Aguiló, Nacho; Gonzalo-Asensio, Jesús (2021-12). «MTBVAC, a live TB vaccine poised to initiate efficacy trials 100 years after BCG». Vaccine 39 (50): 7277-7285. ISSN 0264-410X. doi:10.1016/j.vaccine.2021.06.049. Consultado el 13 de diciembre de 2021.
- Spertini, François; Audran, Régine; Chakour, Reza; Karoui, Olfa; Steiner-Monard, Viviane; Thierry, Anne-Christine; Mayor, Carole E; Rettby, Nils et al. (2015-12). «Safety of human immunisation with a live-attenuated Mycobacterium tuberculosis vaccine: a randomised, double-blind, controlled phase I trial». The Lancet Respiratory Medicine (en inglés) 3 (12): 953-962. doi:10.1016/S2213-2600(15)00435-X. Consultado el 15 de diciembre de 2021.
- Tameris, Michele; Mearns, Helen; Penn-Nicholson, Adam; Gregg, Yolande; Bilek, Nicole; Mabwe, Simbarashe; Geldenhuys, Hennie; Shenje, Justin et al. (2019-09). «Live-attenuated Mycobacterium tuberculosis vaccine MTBVAC versus BCG in adults and neonates: a randomised controlled, double-blind dose-escalation trial». The Lancet Respiratory Medicine (en inglés) 7 (9): 757-770. doi:10.1016/S2213-2600(19)30251-6. Consultado el 13 de diciembre de 2021.
- «Strategic actions supporting large-scale clinical trials 2019». EDCTP (en inglés estadounidense). Consultado el 15 de diciembre de 2021.