Tegaserod
El Tegaserod es un fármaco agonista parcial de los receptores de serotonina 5-HT4, desarrollado por Novartis.
| Tegaserod | ||
|---|---|---|
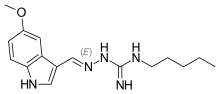 | ||
 | ||
| Nombre (IUPAC) sistemático | ||
| (2E)-2-[(5-Metoxi-1H-indol-3-yl)metilene]-N-pentilhidrazinacarboximidamida | ||
| Identificadores | ||
| Número CAS | 189188-57-6 | |
| Código ATC | A03AE02 | |
| PubChem | 5362436 | |
| DrugBank | DB01079 | |
| ChemSpider | 10609889 | |
| UNII | 458VC51857 | |
| KEGG | D02730 | |
| ChEMBL | 76370 | |
| Datos químicos | ||
| Fórmula | C16H23N5O | |
| Peso mol. | 301.39 g/mol | |
|
InChI=1S/C16H23N5O/c1-3-4-5-8-18-16(17)21-20-11-12-10-19-15-7-6-13(22-2)9-14(12)15/h6-7,9-11,19H,3-5,8H2,1-2H3,(H3,17,18,21)/b20-11+
Key: IKBKZGMPCYNSLU-RGVLZGJSSA-N | ||
| Datos clínicos | ||
| Cat. embarazo | B3 (AU) Los estudios en animales no han demostrado efectos adversos sobre el feto, pero no hay estudios clínicos adecuados y bien controlados hechos en embarazadas. Puede emplearse con vigilancia médica. (EUA) | |
Propiedades
Tegaserod es un estimulante de la motilidad. Su efecto terapéutico se debe a la activación de los receptores 5-HT4 del sistema nervioso en el tracto gastrointestinal.[1] Pertenece a los agonistas de la serotonina.
Indicaciones
El producto se indica para el tratamiento del dolor y malestar abdominales de la distensión, y la función intestinal alteradas en pacientes con síndrome del intestino irritable (SII o IBS pos sus siglas en inglés) cuyos síntomas principales son: dolor, distensión y estreñimiento.[2]
Efectos adversos
El principal efecto del producto es la Diarrea y raramente diarrea severa. De manera rara se han presentado Rash, Urticaria y Prurito.
Restricción en su venta
En marzo del 2007 la FDA de común acuerdo con Novartis recomendó detener la comercialización del producto en los Estados Unidos y Canadá, luego de encontrar una diferencia significativa en 29 estudios retrospectivos del riesgo cardiovascular contra los datos del placebo.[3]
Referencias
- Novartis Pharmaceuticals Corporation (ed.). «New Data for Zelnorm». Archivado desde el original el 9 de diciembre de 2007. Consultado el 22 de febrero de 2012.
- FDA (ed.). «FDA approves first treatment for women with irritable-bowel syndrome». FDA Talk Paper (en inglés). Archivado desde el original el 5 de febrero de 2007. Consultado el 22 de febrero de 2012.
- «Food and Drug Administration. Questions and Answers About the Voluntary Discontinuation of Zelnorm’s (tegaserod maleate) Treatment Investigational New Drug (IND)». fda.gov (en inglés). 30 de marzo de 2007. Consultado el 20/12/16.